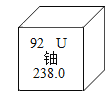
题目内容
【题目】工业上用钛白渣[主要成分为 FeSO4 ,还含有少量 Fe2(SO4)3、MgSO4及 TiOSO4 ]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:

(背景信息)
a 在“溶解”时,TiOSO4 跟水发生反应,生成难溶于水的 H2TiO3和另一种溶于水的酸;
b 在“除杂”时,加入 NH4HF2 固体是为了使溶液显弱碱性,使 Mg 2+ 能与 OH-结合生成沉淀,从而可除去 Mg 2+ ;
c 在“氧化”中,Fe 3+与 OH-也可能结合成沉淀。
(1)操作 X 的名称是_______________。
(2)TiOSO4 与水发生反应的化学方程式为_________________________________。
(3)实验测得“氧化”时溶液的温度、pH 对氧化铁黄产率的影响如下图所示。

①氧化时反应的温度最适宜控制在_________________℃。
②氧化时最好控制 pH 在_____________左右,pH 过小或过大均会导致氧化铁黄产率偏低。请分析pH 过大会导致氧化铁黄产率偏低的可能原因:___________________。
【答案】过滤 ![]() 40 4.5 铁离子与氢氧根离子结合形成沉淀
40 4.5 铁离子与氢氧根离子结合形成沉淀
【解析】
(1)由图可知,操作X实现了固液分离,故操作X的名称是:过滤;
(2)TiOSO4 跟水发生反应,生成难溶于水的 H2TiO3和另一种溶于水的酸,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Ti、O、S、H元素,生成物中含H、Ti、O元素,故生成物中还应含S元素,故生成的酸应为硫酸,该反应的化学方程式为:![]() ;
;
(3)①由图可知,氧化铁黄的产率随温度的升高先增加后减小,40℃时,产率增大,故温度最适宜控制在40℃;
②由图可知,氧化铁黄的产率随pH的增大先增加后减小,当pH=4.5时,产率最大,故氧化时最好控制pH在4.5左右;
pH过大,溶液中含有氢氧根离子,铁离子能与氢氧根离子结合生成氢氧化铁沉淀,故会导致氧化铁黄产率偏低,故填:铁离子与氢氧根离子结合形成沉淀。

 名师点睛字词句段篇系列答案
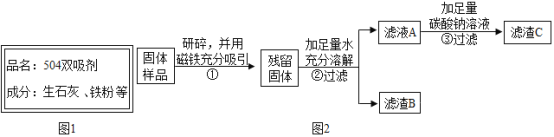
名师点睛字词句段篇系列答案【题目】小明在家里的月饼包装盒中发现一包袋装防腐剂,品名为“504双吸剂”,其标签如图所示,同学们对这包久置的“504双吸剂”固体样品很好奇,设计实验进行探究
(提出问题)久置固体的成分是什么?
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
(实验探究)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中,滴加足量的__. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有__,一定不含Fe2O3 |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是__.他设计图2所示实验方案继续探究.
(1)步骤①样品用磁铁吸引前需经过研碎处理,研碎的目的是__.
(2)步骤②中固体溶解时放出大量的热,由此可判断原固体中一定含有__.
(3)步骤③中反应的化学方程式是__.
(4)乙同学对滤渣B进一步探究.取少量滤渣B于试管中,滴加足量的稀盐酸,并将产生的气体通入澄清石灰水中,观察到固体逐渐消失、有气泡产生、溶液变成黄色、澄清石灰水变浑浊,由此得出结论,原固体中一定含有__.
(5)丙同学认为乙同学的实验还无法确定原固体中是否含有Ca(OH)2,他的理由是__.