题目内容
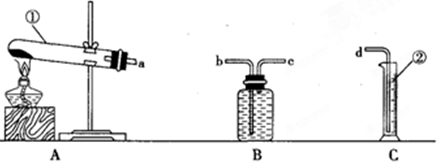
化学兴趣小组利用下图所示装置,测定某碳酸饮料中CO2的含量。

资料:①CO2与足量Ba(OH)2反应生成BaCO3沉淀。②NaHCO3与盐酸反应生成CO2
将一瓶饮料冷藏24小时(未结冰),开封后取一定量样品加入到盛有过量NaOH溶液的容器中,充分反应后作待测液。
回答下列问题:
(1)装置B中仪器①②的名称分别为 和 。加入足量盐酸,仪器②中发生的化学反应方程式为 、 。
(2)反应后持续缓缓通入空气,若缺少装置A,则实验结果 (填“偏大”、“偏小”或“无影响”,下同),若饮料未冷藏,则实验结果 。
(3)装置D的作用是 ,若冷藏温度过低,饮料结冰,则实验结果明显偏小,可能的原因是 。若不测定C中BaCO3的质量,只测定C在实验前后的质量差,则实验结果明显偏高,原因是 。
(4)下列各项措施中,不能提高实验结果准确度的是 。(填字母)
a、滴加盐酸不宜过快
b、在A~B之间添加盛有浓硫酸的洗气装置
c、在B~C之间添加盛有NaHCO3的洗气装置

资料:①CO2与足量Ba(OH)2反应生成BaCO3沉淀。②NaHCO3与盐酸反应生成CO2
将一瓶饮料冷藏24小时(未结冰),开封后取一定量样品加入到盛有过量NaOH溶液的容器中,充分反应后作待测液。
回答下列问题:
(1)装置B中仪器①②的名称分别为 和 。加入足量盐酸,仪器②中发生的化学反应方程式为 、 。
(2)反应后持续缓缓通入空气,若缺少装置A,则实验结果 (填“偏大”、“偏小”或“无影响”,下同),若饮料未冷藏,则实验结果 。
(3)装置D的作用是 ,若冷藏温度过低,饮料结冰,则实验结果明显偏小,可能的原因是 。若不测定C中BaCO3的质量,只测定C在实验前后的质量差,则实验结果明显偏高,原因是 。
(4)下列各项措施中,不能提高实验结果准确度的是 。(填字母)
a、滴加盐酸不宜过快
b、在A~B之间添加盛有浓硫酸的洗气装置
c、在B~C之间添加盛有NaHCO3的洗气装置
(1)分液漏斗,锥形瓶。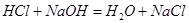 ,
,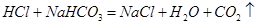 (2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c
(2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c
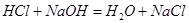 ,
,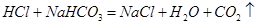 (2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c
(2)偏大,偏小(3)防止空气当中的二氧化碳进入C装置。饮料结冰后,因为溶剂量减小导致二氧化碳在液体中溶解总量变小。有HCl气体和水蒸气进入C装置中。(4)b c气体在液体中的溶解度是温度越高溶解度越低,温度越低溶解度越大。但是当溶剂比如水结冰后,作为溶剂的水的量减少,导致二氧化碳在水中的溶解量降低。在AB之间加浓硫酸洗气装置可以防止A装置及空气中的水蒸气进入装置C,所以对于提高实验结果准确度有一定作用。在BC之间加盛有NaHCO3的洗气装置,可以吸收氯化氢气体,只有二氧化碳气体进入C装置,对于提高精度有一定作用。

练习册系列答案
相关题目