��Ŀ����
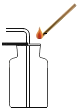
����Ŀ��ʵ���ҳ��ö���������Ũ�������Ʊ���������Ӧԭ��Ϊ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��ʵ��װ����ͼ1��ʾ��
MnCl2+Cl2��+2H2O��ʵ��װ����ͼ1��ʾ�� 
���������ϡ�
�������ǻ���ɫ���ж������壬�����ڱ���ʳ��ˮ��
��������������������Һ��Ӧ�������Ȼ��ơ��������ƣ�NaClO����ˮ��
�۳��³�ѹ�£��������ܶ�Ϊ0.09g/L��
��1�����ش����⡿
װ��B������Ϊ��
����װ��C�жϣ��������ܶȱȿ��������С������
װ��D������Ϊ���û�ѧ����ʽ��ʾ��
��2�����������⡿
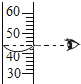
�Ʊ������У�������Ũ���½����·�Ӧֹͣ��ij��ѧ��ȤС��ͬѧΪ�ⶨװ��A�з�Ӧ�����Һ��HCl������������������ײⶨ������ͼ3��ʾ
�������в���m������Ϊ �� ͨ���������ɳ��������������������Һ��HCl�������������˲ⶨ������������С������С����ģ�ԭ������
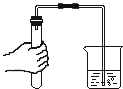
��3������������ͼ2װ�ã��̶�������װ�����ԣ����вⶨ��
��ʵ������й۲쵽п�����������ݲ�������Ӧ�Ļ�ѧ����ʽΪ��
�ڵ�װ�ûָ�������ʱ����÷�Ӧ������������Ϊ183.5mL�����ݻ�ѧ����ʽ���㣬����Һ��HCl����������Ϊ���٣�
��4������˼���ۡ�
��Ϊ�˱�֤������ⶨ�����ȷ�ԣ���ȷ�����ǣ���бY�ιܣ������ţ�
a����������Һת�Ƶ�п���� b����п��ת�Ƶ�������Һ��
��Y�ι��ڿ�������������IJ�������С���û�С���Ӱ�죮
���𰸡�
��1����ȥ�����л��е��Ȼ������壻��Cl2+2NaOH�TNaCl+NaClO+H2O
��2����������У�����Һ�е�MnCl2Ҳ����AgNO3��Һ��Ӧ���ɳ�������ɲ���ֵƫ��
��3��
Zn+2HCl=ZnCl2+H2��
�����Һ�е�HCl������Ϊx
Zn+2HCl=ZnCl2+H2��
73 2
x 0.09 g/L��0.1835 L
![]()
X=0.6 g
����Һ��HCl������������![]() =12.0%
=12.0%
�𣺲���Һ�е�HCl����������Ϊ12.0%
��4��b��û��
���������⣺��1������������Ũ�������Ʊ���������ȡ�������г����лӷ������Ȼ������壬װ��B������Ϊ��ȥ�Ȼ������壻����װ��C�жϣ����峤���̳���˵��������ܶȱȿ����������ж����ŷ��ڿ����л������Ⱦ����������������Һ���գ���Ӧ�ķ���ʽΪ��Cl2+2NaOH�TNaCl+NaClO+H2O����2���ٷ����������в���m������Ϊ�������������Ũ���ᷴӦ�����Ȼ��̣�Ҳ������������Ӧ���ʲ��������ⶨ����Һ���������������Ӧ�����У��ڷ�����пת�Ƶ�������Һ�У���Ӧ�ķ���ʽΪ��Zn+2HCl=ZnCl2+H2����
�⣺�����Һ�е�HCl������Ϊx
Zn+2HCl=ZnCl2+H2��
73 2
x 0.09 g/L��0.1835 L ![]()
X=0.6 g
����Һ��HCl������������![]() =12.0%
=12.0%
�𣺲���Һ�е�HCl����������Ϊ12.0%��
3����пת�Ƶ�������Һ�У���Ӧ��Ϻ�ÿ���1���Ӷ�ȡ������������������С�����������С��ԭ��������δ��ȴ�����£����¶���ȴ�����º�����������ٸı䣻
��4���������ܶȱȿ���С����Y�ι��ڿ�������������IJ���û��Ӱ�죮
���Դ��ǣ���1����ȥ�����л��е��Ȼ������壻��Cl2+2NaOH�TNaCl+NaClO+H2O��2��������ɣ��������У�����Һ�е�MnCl2Ҳ����AgNO3��Һ��Ӧ���ɳ�������ɲ���ֵƫ��3����Zn+2HCl=ZnCl2+H2��
�⣺�����Һ�е�HCl������Ϊx
Zn+2HCl=ZnCl2+H2��
73 2
x 0.09 g/L��0.1835 L ![]()
X=0.6 g
����Һ��HCl������������![]() =12.0%
=12.0%
�𣺲���Һ�е�HCl����������Ϊ12.0%��
4��b��û��
�����㾫����������Ŀ����֪������������������ȡ�ͼ������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ����������ʵ�����Ʒ�ԭ����Zn + H2SO4 = ZnSO4 +H2����Zn + 2HCl = ZnCl2 +H2��������Ũ�����ԭ�� Ũ������ǿ�ӷ��� ��������Ũ����������ԭ�� Ũ�����������ǿ�����ԣ�ע�⣺a����ƽ b������ c�����ţ�