题目内容
【题目】正确的实验操作是科学探究成功的基础.下列操作中错误的是( )
A.
读出液体体积
B.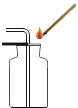
CO2的验满
C.
检查装置气密性
D.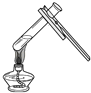
加热液体
【答案】A
【解析】解:A、读取量筒内的液体体积时,视线要与液体凹液面的最低处保持相平,操作错误;
B、验满二氧化碳气体时,把燃着的木条放在集气瓶口,若熄灭,证明已满,操作正确;
C、检查装置气密性时,将导管伸入烧杯内水中,两手紧握试管壁,导管口有气泡冒出,说明装置气密性良好,操作正确;
D、给试管内的液体加热时,液体的量不能超过试管容积的 ![]() ,利用试管夹夹持试管加热时,手不能拿着试管夹的短柄,会导致试管脱落,操作正确.
,利用试管夹夹持试管加热时,手不能拿着试管夹的短柄,会导致试管脱落,操作正确.
故选A.
【考点精析】通过灵活运用量筒的使用方法和液体加热的注意事项,掌握量取液体体积时,量筒必须放平稳.视线与刻度线及量筒内液体凹液面的最低点保持水平.量筒不能用来加热,不能用作反应容器.量程为10毫升的量筒,一般只能读到0.1毫升;加热液体时,液体体积不超过试管容积的1/3,加热时使试管与桌面约成450角,受热时,先使试管均匀受热,然后给试管里的液体的中下部加热,并且不时地上下移动试管,为了避免伤人,加热时切不可将试管口对着自己或他人即可以解答此题.

练习册系列答案
相关题目
【题目】如图为某反应的部分微观示意图,其中不同的球代表不同种原子.下列说法正确的是( ) 
A.该反应属于置换反应
B.1个X分子中有3个原子
C.反应物中分子的个数比为1:1
D.![]() 的化合价在反应前后未改变
的化合价在反应前后未改变
【题目】有一溶液X,分别滴加到盛有氯化钡、氢氧化钠、氯化钠溶液的试管中,出现的现象如表,则溶液X是( )
试管中盛放物质 | 氯化钡溶液 | 氢氧化钠溶液 | 氯化钠溶液 |
现象 | 出现白色沉淀 | 出现蓝色沉淀 | 无明显现象 |
A.H2SO4溶液
B.Na2CO3溶液
C.CuCl2溶液
D.CuSO4溶液