题目内容
【题目】分类、类比、推理都是学习化学常用的方法。
(1)化学实验的设计首先要考虑实验目的,其次还要考虑操作的便利性、安全性和节约药品等等。
|
|
|
A | B | C |
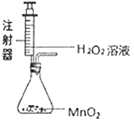
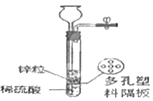
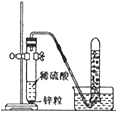
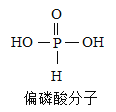
上述实验A可以与______(填“B”或“C”)归为一类,这两个实验在设计中均注意了实验的便利性的设计,两个实验中实验便利性是指他们的实验设计均可以使反应______,同另一个实验相比较他们还有一个优点是______。
(2)通过学习我们知道有些氧化物与水反应可以生成对应的酸或碱。如:CaO+H2O=Ca(OH)2或CO2+H2O=H2CO3等。实际上可溶性的碱、强酸都可以由氧化物与水反应得到,按照此规律:
①氢氧化钾可以由水与______(填化学式)反应得到。
②写出氧化物与水反应得到硫酸的化学方程式______。
【答案】B 随时发生、随时停止 可节约药品 K2O SO3+H2O=H2SO4
【解析】
(1)装置A和装置B都是对原装置进行的改进,所以实验操作更便利;两个实验中实验便利性是指他们的实验设计均可以使反应随时发生、随时停止,同另一个实验相比较它们还有一个优点是节约药品。故填:B;随时发生、随时停止;可节约药品。
(2)①由题干信息可知,某些金属氧化物能与水反应生成碱,所以氧化钾和水反应生成氢氧化钾;故填:K2O;
②硫酸中,硫元素显+6价,三氧化硫中,硫元素显+6价,所以三氧化硫能与水反应生成硫酸;故填:SO3+H2O=H2SO4。

 黄冈天天练口算题卡系列答案
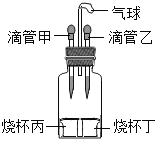
黄冈天天练口算题卡系列答案【题目】如图所示装置(气密性良好),若先将甲中液体滴入丙中,观察到气球明显鼓起,一段 时间后恢复到原状;再将乙中液体滴入丁中,气球又明显鼓起。下列组合正确的是( )
选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
A | 过氧化氢溶液 | 二氧化锰 | 水 | 氯化钠 |
B | 稀硫酸 | 锌 | 盐酸 | 碳酸钠 |
C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
D | 水 | 氧化钙 | 盐酸 | 镁 |
A. AB. BC. CD. D