题目内容
【题目】为测定某黄铜(铜锌合金)中铜的质量分数,称取46.5g该黄铜粉末放入烧杯中,再向烧杯内加入100g稀硫酸(足量),测得烧杯内(不含烧杯)剩余物质的质量随时间的变化曲线如图所示:
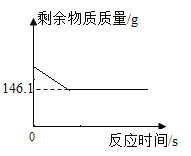
(1)完全反应生成氢气的质量为___________________________g。
(2)计算该黄铜中铜的质量分数___________。(写出计算过程,答案精确到0.1% )
【答案】0.4 72.0%
【解析】
锌和稀硫酸反应生成硫酸锌和氢气。
(1)由质量守恒定律可知,反应前反应物的总质量等于生成物的总质量,减少的为生成的气体的质量,完全反应生成氢气的质量为![]() 。
。
(2)设参加反应的锌的质量为x
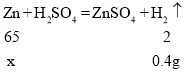
![]()
![]()
该黄铜中铜的质量为![]() ;
;
该黄铜中铜的质量分数为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。同学们对此气体展开了一系列探究。
(1)如果推测此气体是二氧化碳,验证它的实验方案如下:
猜想 | 实验步骤 | 现象与结论 |
此气体可能是CO2 | _____ | _____ |
产生此气体的化学方程式可能是_____;
(2)若想制取该气体,采用的发生装置可选取下图中的_____,收集装置应选用_____(填序号);
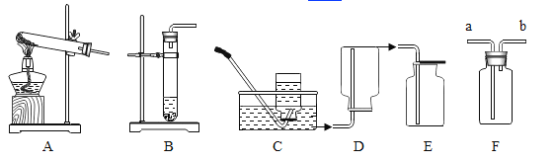
(3)如用下图中F装置收集该气体,气体应由_____端导入(填“a”或“b”)。
【题目】近年来,帆船比赛作为一项极限运动受到越来越多的追捧。帆船的主体结构材质如下:
结构 | 船体 | 船帆 | 桅杆 |
材质 | 玻璃钢 | 聚酯纤维 | 铝合金 |
(1)上述材质中属于金属材料的是___________________________。
(2)铝制品在空气中不易锈蚀的原因是___________________________。
(3)铝的化学性质比较活泼,常温下可以和氢氧化钠溶液反应,生成偏铝酸钠(NaAlO2)和氢气,写出该反应的化学方程式:___________________________。
【题目】兴趣小组的同学为探究碳酸钠的性质做了如下实验,请你一起完成。
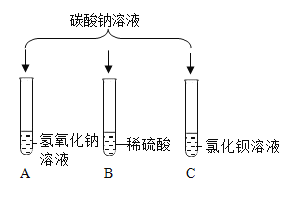
(1)试管A中没有发生反应,原因是__________________。
(2)试管B中的现象是_________________;试管C中发生反应的化学方程式为________________。
(3)上述实验结束后,该组同学将A、B、C三支试管中的废液倒入同--烧杯中,然后过滤得到滤液①,为确定滤液①的成分,同学们做了如下实验探究:
实验操作 | 实验现象 | 实验分析 | |
(4) | 取少量滤液①于试管中,向其中加入足量的氯化钡溶液,过滤,得到沉淀和滤液②, 向沉淀中加入足量稀硝酸 | 产生白 色沉淀; 加入稀硝酸后白色沉淀部分消失 | 根据实验现象可知,滤液②中一定含有_______________(填写溶质的化学式) |
(5) | 取少量滤液②于试管中,________________。 | ____________。 | 根据实验现象可知,滤液①中一定含有氢氧化钠 |
[实验结论](6)同学们通过分析推理,得出结论:滤液①中共含有_______________种溶质。
[实验反思](7)向滤液①中加入足量的氯化钡溶液的目的是________________。