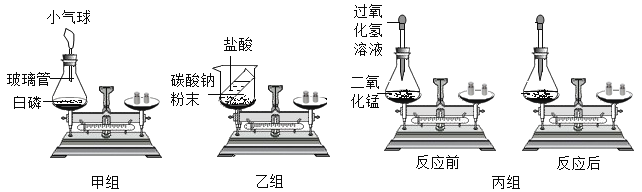
题目内容
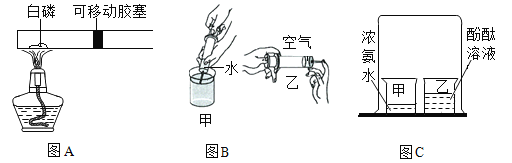
【题目】在已调节至平衡的托盘天平的两托盘上各放一只质量相同的烧杯,在两只烧杯里分别加入100g溶质质量分数为19. 6%的稀硫酸;然后在左盘的烧杯中加入2.4 g镁粉,欲使天平恢复平衡,可向右盘中加入
A.2.2 g氢氧化钠
B.5.3g碳酸钠
C.2.4 g氧化镁
D.5.6 g铁粉
【答案】A
【解析】
镁粉与稀硫酸反应生成硫酸镁和氢气,设2.4g镁粉完全反应生成氢气的质量为x,需消耗硫酸的质量为y
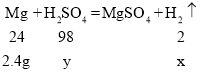
![]() x=0.2g
x=0.2g
![]() y=9.8g
y=9.8g
故该反应酸过量,镁粉可以完全反应,左盘增加的质量为2.4g-0.2g=2.2g。
A、氢氧化钠与稀硫酸反应生成硫酸钠和水,化学方程式为:![]() ,根据质量守恒定律,化学反应前后,物质的总质量不变,且该反应无气体生成,故加入2.2 g氢氧化钠后右盘增加质量为2.2 g,符合题意;
,根据质量守恒定律,化学反应前后,物质的总质量不变,且该反应无气体生成,故加入2.2 g氢氧化钠后右盘增加质量为2.2 g,符合题意;
B、碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳,设5.3g碳酸钠完全反应生成二氧化碳的质量为x,需消耗硫酸的质量为y
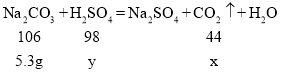
![]() x=2.2g
x=2.2g
![]() y=4.9g
y=4.9g
故该反应酸过量,碳酸钠可以完全反应,因此加入5.3 g碳酸钠溶液后右盘增加的质量为5.3g-2.2g=3.1g,不符合题意;
C、氧化镁与稀硫酸反应生成硫酸镁和水,![]() ,根据质量守恒定律,化学反应前后,物质的总质量不变,且该反应无气体生成,故加入2.4 g氧化镁后右盘增加的质量为2.4 g,不符合题意;
,根据质量守恒定律,化学反应前后,物质的总质量不变,且该反应无气体生成,故加入2.4 g氧化镁后右盘增加的质量为2.4 g,不符合题意;
D、铁与稀硫酸反应生成硫酸亚铁和氢气,设5.6g镁粉完全反应生成氢气的质量为x,需消耗硫酸的质量为y
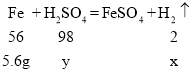
![]() x=0.2g
x=0.2g
![]() y=9.8g
y=9.8g
故该反应酸过量,铁粉可以完全反应,加入5.6 g铁粉后右盘增加的质量为5.6g-0.2g=5.4g,不符合题意。
故选A。

【题目】化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究.
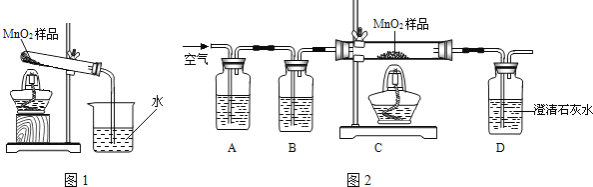
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭.将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是 .
(2)对气体来源的探究:
甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
实验步骤及现象 | 结论 |
加热空的试管,另一端的澄清石灰水没有变浑浊 | 假设 (填“不成立”或“成立”). |
乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体.他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是 ,实验中观察到D处澄清石灰水变浑浊.他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊.
通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体.