题目内容
【题目】密闭容器内有M、N、P、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表,下列说法不正确的是( )
物质 | M | N | P | Q |
反应前质量/g | 19.7 | 8.7 | 31.6 | 0.4 |
反应后质量/g | 待测 | 17.4 | 19.7 | 3.6 |
A. 反应后密闭容器中M的质量为![]()
B. 该反应一定是化合反应
C. 物质P一定是化合物
D. 反应生成的N与Q的质量之比为87:32
【答案】B
【解析】
由题意可知,根据质量守恒定律,反应前各物质的质量总和=反应后生成各物质的质量总和,设待测值为a,则可列式:19.7+8.7+31.6+0.4=a+17.4+19.7+3.6,a=19.7.M的质量在反应前后没有改变,所以M可能是该反应的催化剂或没有参加反应;N的质量增加,所以N是生成物,且生成N的质量为:17.4g-8.7g=8.7g;P的质量减少,所以是反应物,且参加反应的P的质量为:31.6g-19.7g=11.9g;Q的质量增加,所以是生成物,且生成Q的质量为:3.6g-0.4g=3.2g。
A.由以上分析可知,反应后密闭容器中M的质量为19.7g,故正确;
B.由以上分析可知,该反应的反应物是P,生成物是N和Q,符合“一变多”的特征,属于分解反应,故错误;
C.由以上分析可知,该反应的反应物是P,且该反应属于分解反应,所以物质P一定是化合物,故正确;
D.反应生成的N与Q的质量之比为8.7g:3.2g=87:32,故正确。
故选:B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】目前大部分城市居民所使用的燃料主要是管道煤气或天然气,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下:
2CO+O2![]() 2CO2;2H2+O2
2CO2;2H2+O2![]() 2H2O ;CH4+2O2
2H2O ;CH4+2O2![]() CO2+2H2O
CO2+2H2O
(1)根据以上化学方程式判断,相同条件下,燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是__________,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是______进风口(填“增大”或“减小”),如不改进可能产生的不良后果是___________。
(2)家庭煤气管常用硬质聚氯乙烯和聚乙烯塑料管,塑料管属于_______材料。
(3)管道煤气中含有的烃类,除甲烷外还有少量乙烷、丙烷、丁烷等的某些性质见下表:
乙烷 | 丙烷 | 丁烷 | |
熔点/℃ | -183.3 | -189.7 | -183.4 |
沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是:________________。
【题目】金属材料广泛应用于生产生活中。
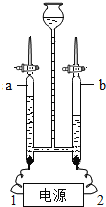
小张利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)
查阅资料:Fe3O4在常温下能与稀盐酸反应,方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,不与CuSO4溶液反应。
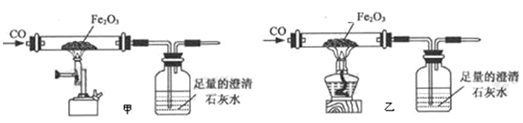
A 实验开始时应先通CO,目的是:_____;
B 从环保角度考虑,图示装置还应采取的改进措施是_____。
C 两实验过程中,澄清石灰水均变浑浊,发生的化学反应方程式为:_____,完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
2 | 取黑色粉末,加入稀盐酸 | 全部溶解,有大量气泡 | 全部溶解,无气泡产生 |
3 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质产生 | 无明显现象 |
(1)甲组的黑色粉末与稀盐酸反应的化学方程式是_____。
(2)根据实验现象,乙组实验玻璃管中发生的反应方程式为:_____。
(3)甲、乙两组实验说明温度对CO和Fe2O3反应_____(填有、无或不确定)影响。