题目内容
【题目】如图是甲、乙、丙三种物质的溶解度曲线。
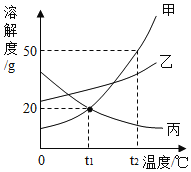
(1)t1℃时,三种物质的溶解度由小到大的顺序是______。
(2)t2℃时,要使甲物质的饱和溶液变为不饱和溶液,可采用的方法是______。
(3)t1℃时,A、B两烧杯中分别盛有等质量甲、丙的饱和溶液,将烧杯中的溶液都升温到t2℃时,在B烧杯中观察到的现象是______,此时两种溶液的溶质质量分数大小关系是______。
(4)t1℃时,将25g甲物质放入100g水中充分溶解。根据甲物质的溶解度曲线计算:末溶解的甲物质的质量是______g.所得溶液中溶质的质量分数是______(精确到0.1%)。
【答案】甲=丙<乙 升温或增加溶剂 有晶体析出 甲>丙 5 16.7%
【解析】
(1)通过分析溶解度曲线可知,t1℃时,三种物质的溶解度由小到大的顺序是:甲=丙<乙;
(2)甲物质的溶解度随温度的升高而增大,所以t2℃时,要使甲物质的饱和溶液变为不饱和溶液,可采用的方法是:升温或增加溶剂;
(3)t1℃时甲、丙溶解度相等,甲、丙的饱和溶液的溶质质量分数相等。t1℃时,A、B两烧杯中分别盛有等质量甲、丙的饱和溶液,将烧杯中的溶液都升温到t2℃时,丙物质的溶解度随温度的升高而减小,所以在B烧杯中观察到的现象是:有晶体析出,此时两种溶液的溶质质量分数大小关系是:甲>丙;
(4)t1℃时,甲的溶解度是20g,根据溶解度概念可知,t1℃时,100g水中最多溶解20g甲,所以将25g甲放入100g水中充分溶解,末溶解的甲的质量是5g.所得溶液中溶质的质量分数=![]() 。
。

【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实 验 装 置 |
铁丝在氧气中燃烧 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
排水法收集氧气 |
解释 | 集气瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水: 吸收二氧化硫,防止污染空气 | 量筒中的水: 降温,吸收白烟 | 集气瓶中的水:水先将集气瓶内的空气排净后,便于观察O2何时收集满 |
A | B | C | D |
A. AB. BC. CD. D
【题目】密闭容器内有M、N、P、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表,下列说法不正确的是( )
物质 | M | N | P | Q |
反应前质量/g | 19.7 | 8.7 | 31.6 | 0.4 |
反应后质量/g | 待测 | 17.4 | 19.7 | 3.6 |
A. 反应后密闭容器中M的质量为![]()
B. 该反应一定是化合反应
C. 物质P一定是化合物
D. 反应生成的N与Q的质量之比为87:32