题目内容
(6分) “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,进行实验。取10 g样品加入50 g稀硫酸中,恰好完全反应,称量剩余物为59.9g。
求:(1)产生氢气的质量 。
(2)计算黄铜样品中铜的质量分数。
(1)0.1g(2)67.5%
解析试题分析:依据质量守恒定律化学反应前后物质的总质量不变可知减少的质量即为生成的氢气的质量:
产生氢气的质量=10g+50g-59.9g=0.1g
(2)利用化学方程式中氢气与锌反应的质量比即可计算出锌的质量,用合金的质量减去锌的质量即为铜的质量。
解:设锌的质量为x
Zn+H2SO4====ZnSO4+H2↑
65 2
x 0.1g
65︰2=x︰0.1g
解得 x=3.25g
10g-3.25g=6.75g
6.75g ÷ 10g × 100% = 67.5%
答:黄铜样品中铜的质量分数是67.5%…
考点:利用化学方程式的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
相同质量的下列物质①Zn②ZnO③Zn(OH)2④ZnCO3,分别跟质量分数都相同且适量的稀盐酸充分反应,所得溶液的溶质质量分数的关系正确的是 ( )
| A.①>②>③>④ | B.④>③>②>① |
| C.①>②=④>③ | D.④>①>②=③ |
(7分)某同学做了如下图所示实验:
| | 第一次 | 第二次 |
| 加入镁粉的质量 | m | m |
| 加入质量分数为14.6%稀盐酸的质量 | 50g | lOOg |
| 加入氢氧化钠溶液的质量 | 100g | 100g |
| 加入氢氧化钠溶液后的实验现象 | 产生白色沉淀 | 无明显现象 |
(1)写出第一次实验中发生反应的化学方程式___________________________;
(2)第二次反应后溶液中溶质的组成是___________________________;
(3)每次实验中加入镁的质量(m)为___________________________;
(4)求解第一次反应中生成气体的质量(X)的比例式为___________________________;
(5)若将第一次反应后溶液蒸发掉68.4g水后,则所得不饱和溶液中溶质的质量分数___________;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为_______________。
(7分)菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2S04溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
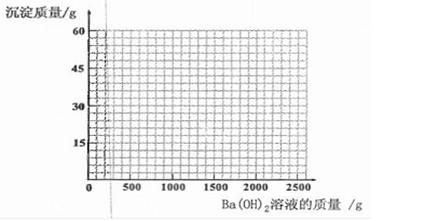
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境的影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了l.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)