题目内容
【题目】某活动小组在实验室模拟铁矿石炼铁化学原理,如图所示。
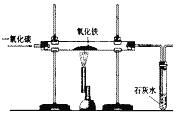
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:
①给硬质玻璃管加热②停止加热③通入一氧化碳气体④停止通入一氧化碳气体,正确的操作步骤是(填序号)________。
(2)硬质玻璃管中反应的化学方程式是___________。
(3)图中有一处明显错误,请说明改进方法:____________。
(4)某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4g钢样品和20.0g稀盐酸(足量)放入质量为120.0g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量。记录如下表:(最后结果保留一位小数)
反应时间 | T0 | T1 | T2 | T3 |
烧杯和药品质量/g | 151.4 | 151.3 | 151.0 | 151.0 |
反应中产生氢气的质量是______g。
(5)请计算钢样品中铁的质量分数______。
【答案】③①②④ 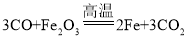 点燃尾气或利用小气球收集尾气 0.4g 98.2%
点燃尾气或利用小气球收集尾气 0.4g 98.2%
【解析】
根据还原反应步骤先通气体冷却了停止通气及化学方程式计算进行解答。
(1)CO还原Fe2O3的实验中CO具有可燃性故加热前要先通CO将装置内原有空气排尽防止爆炸,反应结束后熄灭酒精灯后硬质玻璃管冷会导致压强变小,会引起倒吸现象,所以实验结束时应该先熄灭酒精灯等冷却后再停止通CO,故正确的操作步骤是(填序号):③①②④;
(2)硬质玻璃管中反应为CO高温还原Fe2O3其化学方程式是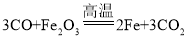 ;
;
(3)CO为有毒气体,直接排放会污染空气,故图中有一处明显错误为缺少尾气处理装置,请说明改进方法为:点燃尾气或利用小气球收集尾气。
(4)由题目条件和表格数据可知反应前物质总质量为151.4g,反应后最终质量为151.0g,根据质量守恒定律反应前后总质量不变可知生成的氢气质量为151.4g-151.0g=0.4g。
(5)解:设样品中铁的质量为x。
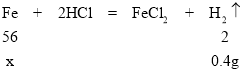
![]() ,得x=11.2g,则钢样品中铁的质量分数为
,得x=11.2g,则钢样品中铁的质量分数为![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案