题目内容
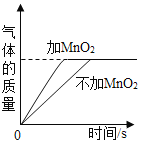
【题目】黄铜是铜锌合金,耐腐蚀,许多金色饰品就是用它来制作的.现称取20.0g黄铜样品置于烧杯中,慢慢加人稀硫酸使其充分反应,直至没有气泡产生为止.请结合下列图示计算.

(1)该20.0g黄铜样品中含锌的质量为_____g.
(2)完全反应时生成气体的质量为_____g.(写出计算过程)
(3)过滤后得到滤液的质量是_____克.
【答案】6.5 0.2 86.3
【解析】
由题意可知,剩余的13.5g滤渣为铜,则锌的质量的为20.0g﹣13.5g=6.5g.
设生成的氢气的质量为x
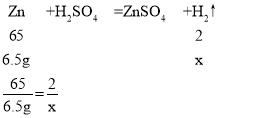
x=0.2g
过滤后得到滤液的质量是6.5g+80.0g﹣0.2g=86.3g.
答:(1)该20.0g黄铜样品中含锌的质量为 6.5g.
(2)完全反应时生成气体的质量为 0.2g.
(3)过滤后得到滤液的质量是 86.3克

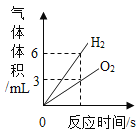
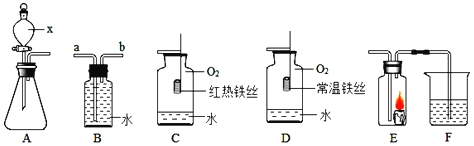
【题目】某活动小组在实验室模拟铁矿石炼铁化学原理,如图所示。
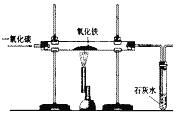
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:
①给硬质玻璃管加热②停止加热③通入一氧化碳气体④停止通入一氧化碳气体,正确的操作步骤是(填序号)________。
(2)硬质玻璃管中反应的化学方程式是___________。
(3)图中有一处明显错误,请说明改进方法:____________。
(4)某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4g钢样品和20.0g稀盐酸(足量)放入质量为120.0g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量。记录如下表:(最后结果保留一位小数)
反应时间 | T0 | T1 | T2 | T3 |
烧杯和药品质量/g | 151.4 | 151.3 | 151.0 | 151.0 |
反应中产生氢气的质量是______g。
(5)请计算钢样品中铁的质量分数______。
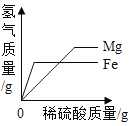
【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质