题目内容
【题目】.某同学欲测定某石灰石样品中碳酸钙的质量分数.取12.5g石灰石样品于烧杯中,再向其中加入100g稀盐酸,恰好完全反应后,测得烧杯内物质的总质量变为108.1g(已知:石灰石中的杂质既不溶于水,也不与其他物质反应,生成的二氧化碳全部逸出)。试计算:
(1)生成的二氧化碳质量______;
(2)该样品中碳酸钙的质量分数______;
(3)所用稀盐酸的溶质质量分数______。
【答案】4.4g 80% 7.3%
【解析】
(1)由质量守恒可知,二氧化碳的质量为12.5g+100g-108.1g=4.4g;
(2)设样品中碳酸钙的质量为x,消耗的氯化氢的质量为y,则
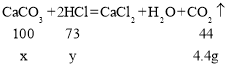
![]()
x=10g,y=7.3g;
样品中碳酸钙的质量分数:![]() ;
;
(3)所用稀盐酸的溶质质量分数:![]() ;
;

【题目】某活动小组在实验室模拟铁矿石炼铁化学原理,如图所示。
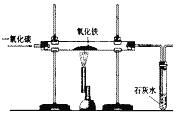
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:
①给硬质玻璃管加热②停止加热③通入一氧化碳气体④停止通入一氧化碳气体,正确的操作步骤是(填序号)________。
(2)硬质玻璃管中反应的化学方程式是___________。
(3)图中有一处明显错误,请说明改进方法:____________。
(4)某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4g钢样品和20.0g稀盐酸(足量)放入质量为120.0g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量。记录如下表:(最后结果保留一位小数)
反应时间 | T0 | T1 | T2 | T3 |
烧杯和药品质量/g | 151.4 | 151.3 | 151.0 | 151.0 |
反应中产生氢气的质量是______g。
(5)请计算钢样品中铁的质量分数______。
【题目】为了探究中和反应,甲、乙两名同学分别向下列两支试管中滴加稀盐酸。
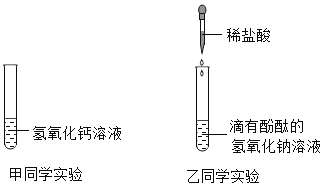
(1)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,边滴加边振荡,乙同学意外发现有气泡产生,说明该氢氧化钠溶液已变质,变质的原因_________________________________ (用化学方程式表示).
(2)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 | 实验现象 | 实验结论 |
取样少许于试管中,先滴加_________,再滴加_________ | ____________ | 氢氧化钠溶液部分变质 |
(3)实验结束后,甲、乙同学将他们两人试管中的废液倒入同一洁净烧杯中,得到无色澄清溶液,分析所得溶液中溶质的成分为①_______________,②_____________________(不考虑酚酞)。
(4)丙同学要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的_________.
A. 氢氧化钡溶液 B. 硝酸钡溶液 C. 氢氧化钙溶液 D. 氯化钠溶液。