题目内容
【题目】某公司发生火灾引发液氨泄露并发生化学爆炸,造成重大伤亡。 液氨是液态的氨气,常温下,氨气 (NH3)是一种无色、有刺激性气味的气体,密度比空气小。实验室常用氯化铵固体与碱石灰固体共热制取氨气。下列相关说法或做法不正确的是
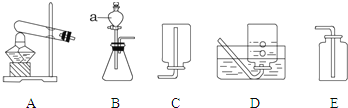
A. 液氨泄漏时,可用喷水的方法除去空气中的氨气,说明氨气溶于水
B. 由液氨发生化学爆炸猜测氨气可能具有可燃性
C. 仪器a的名称是分液漏斗;制取氨气的装置应选择上图中的A E
D. 液氨泄漏时正确的逃生方法是用湿毛巾捂住口鼻并尽量贴近地面逃离
【答案】C
【解析】
氯化铵固体与碱石灰固体共热生成氯化钙和氨气和水。
A、液氨泄漏时,可用喷水的方法除去空气中的氨气,说明氨气溶于水,故A正确;
B、由液氨发生化学爆炸猜测氨气可能具有可燃性,故B正确;
C、仪器a的名称是分液漏斗;制取氨气的装置应选择上图中的A C,故C不正确;
D、液氨泄漏时正确的逃生方法是用湿毛巾捂住口鼻并尽量贴近地面逃离,故D正确。故选C。

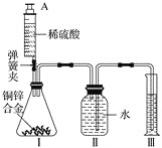
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气; 猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
(查阅资料)(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO![]() Cu+H2O
Cu+H2O
(实验探究)师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。

主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的品红溶液褪色 | 有_____生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | / | / |
④冷却,将A中液体用水稀释 | A中液体变为____色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是____________________。
(2)请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+_______
CuSO4+SO2↑+_______
(3)若猜想二正确,装置E中发生反应的化学方程式是___________________________。
(反思拓展)
下列各组药品能够证明锌的活动性比铜强的是_____(填序号)。
① 锌、铜、稀盐酸 ② 锌、硫酸铜溶液 ③ 锌、铜、氯化镁溶液
【题目】同学们在学习碱的化学性质时,进行了如图所示的实验。
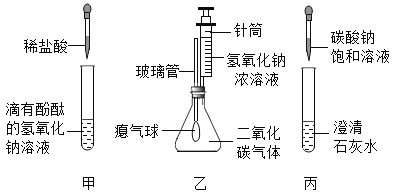
(1)乙实验中滴加氢氧化钠溶液后,可观察到的现象是________。
(2)丙实验中观察到试管内有白色沉淀产生。
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
(提出问题)废液中含有哪些物质?
(交流讨论)①一定含有的物质:碳酸钙、指示剂、水和________(写物质名称)。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是________。(写一种猜想)
(实验设计)小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | ________的猜想正确。 |
②________。 | ________的猜想正确。 | |
③________。 | ________的猜想正确。 |
【题目】在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水,某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
(提出问题)生成物中有哪几种碳的氧化物?
(作出猜想)
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有_____ | 含有CO和CO2 |
(设计实验)依据CO和CO2的性质,兴趣小组同学设计了如下实验:
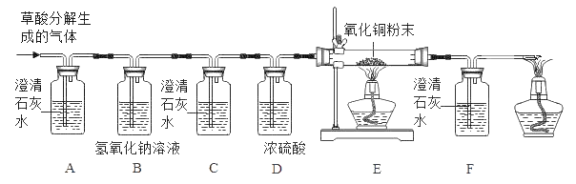
(查阅资料)氢氧化钠可吸收CO2,与CO不反应,浓硫酸可干燥CO
(实验探究)
(1)观察到_____(填序号)装置中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO
①C装置中澄清石灰水不变浑浊,F装置中_____;
②E装置中出现_____的现象。
(实验结论)通过实验探究证明:猜想3成立,草酸分解的化学方程式是_____。
(问题讨论)
(1)B装置的作用是_____;C装置中不变浑浊说明_____;D装置的作用是_____。
(2)装置末端酒精灯的作用是_____。