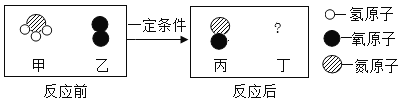
题目内容
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气; 猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
(查阅资料)(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO![]() Cu+H2O
Cu+H2O
(实验探究)师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。

主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的品红溶液褪色 | 有_____生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | / | / |
④冷却,将A中液体用水稀释 | A中液体变为____色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是____________________。
(2)请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+_______
CuSO4+SO2↑+_______
(3)若猜想二正确,装置E中发生反应的化学方程式是___________________________。
(反思拓展)
下列各组药品能够证明锌的活动性比铜强的是_____(填序号)。
① 锌、铜、稀盐酸 ② 锌、硫酸铜溶液 ③ 锌、铜、氯化镁溶液
【答案】二氧化硫 二 蓝 将装置A中生成的二氧化硫气体全部排出 2H2O 2NaOH+SO2=Na2SO3 +H2O ①②
【解析】
[实验探究]①根据资料提供的信息可知,二氧化硫可使品红溶液褪色,装置B中的品红溶液褪色,说明有二氧化硫生成。②点燃装置D处酒精灯,装置D玻璃管中无明显现象,说明无氢气生成,则猜想二正确。④A试管中有硫酸铜生成,加水稀释后A中液体变为蓝色。
[表达交流]
(1)在步骤③中,鼓入空气的目的是将装置A中生成的二氧化硫气体全部排出。
(2)化学反应前后各种原子个数相等,反应前有Cu、4H、2S、8O,反应后有Cu、2S、6O,所以未知物中应有4H、2O,未知物为2H2O,铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)根据资料提供的信息可知,二氧化硫能和碱性溶液反应,若猜想二正确,装置E中发生反应的化学方程式是:2NaOH+SO2=Na2SO3 +H2O。
【反思拓展】
金属活动性顺序中,排在氢前的金属能与酸反应产生氢气;排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来。① 锌能与稀盐酸反应,说明锌在氢前,铜不与稀盐酸反应,说明铜在氢后,该实验说明锌>铜,此选项符合题意;② 将锌片插入硫酸铜溶液中,锌片表面有红色固体出现,说明发生了化学反应,证明锌>铜,此选项符合题意;③ 锌、铜两种金属都不与氯化镁溶液反应,说明三种金属中,镁金属活动性最强,但不能说明锌和铁的金属活动性顺序,此选项不符合题意。故选①②。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】实验室有一瓶失去标签的稀盐酸,化学兴趣小组的同学欲测定此稀盐酸中溶质的质量分数。他们先称取25g研细的石灰石样品放入烧杯中,再向烧杯中逐滴滴加此稀盐酸使其充分反应至无气泡产生(已知石灰石样品中的杂质不与稀盐酸反应)。测得加入稀盐酸的质量与烧杯中物质的质量的相关数据如下表所示,请计算:
加入稀盐酸的质量/g | 0 | 200 |
烧杯中物质的质量/g | 25 | 216.2 |
(1)反应生成二氧化碳的质量_____________;
(2)此稀盐酸中溶质的质量分数_______________。