题目内容
【题目】小明在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是小明对反应后溶液的酸碱性进行了探究。【探究目的】确定反应后溶液的酸碱性
【猜想与假设】反应后溶液呈碱性,也可能呈_____,也可能呈_____。
【实验验证】
实验操作 | 实验现象 | 实验结论 |
| 无色酚酞溶液______ | 溶液呈碱性,使其呈碱性的微粒是_____ |
无色酚酞溶液不变色 | 溶液呈______ |
【继续验证】
实验操作 | 实验现象 | 实验结论 |
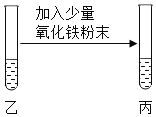
| 粉末部分或全部消失.溶液变为黄色 | 溶液呈_____,反应的化学方程式是_____ |
____________ | 溶液呈______ |
【答案】 中性(或酸性) 酸性或(中性) 变红; OH-; 中性(或酸性) 酸性; Fe2O3+6HCl=2FeCl3+3H2O; 无明显现象; 中性
【解析】(1)当盐酸与氢氧化钠恰好完全反应时,溶液为中性,当氢氧化钠过量时溶液显碱性,当盐酸过量时,溶液显酸性,故另外两种猜想是中性或酸性;
(2)向反应后的溶液中加入无色酚酞时,当溶液变为红色,说明溶液显碱性,使其呈碱性的微粒是OH-;当溶液不发生变化时,溶液可能显酸性或中性;
(3)氧化铁与氢氧化钠不反应,故加入氧化铁后,如粉末部分或全部消失.溶液变为黄色,则说明溶液一定显酸性;该反应是稀盐酸与氧化铁反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;当氧化铁粉末不溶解,溶液无明显现象时,说明溶液一定显中性;

练习册系列答案
相关题目