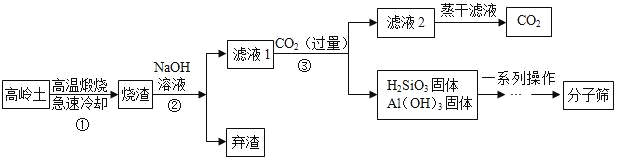
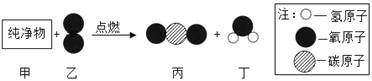
题目内容
【题目】超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
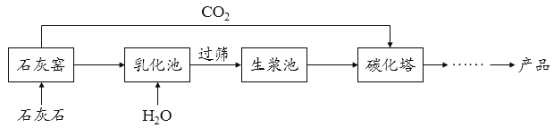
(1)石灰石主要成分的化学式为_____________________。
(2))乳化池中,生石灰与水发生反应,其化学方程式为 __________________。
(3))过筛的目的是拦截____________(填“大于”或“小于”)筛孔直径的颗粒。
(4))碳化塔中反应的化学方程式为 ____________________。
(5)生产过程中循环使用的一种物质是___________
【答案】CaCO3 CaO+H2O=Ca(OH)2 大于 Ca(OH)2+CO2=CaCO3↓+H2O CO2
【解析】
(1)石灰石主要成分是碳酸钙,所以它的化学式为CaCO3,故填:CaCO3;
(2))乳化池中,生石灰与水发生反应,生成氢氧化钙与水,其化学方程式为CaO+H2O=Ca(OH)2,故填:CaO+H2O=Ca(OH)2;
(3))过筛的目的是拦截大于筛孔直径的颗粒,相当于过滤,故填:大于;
(4))碳化塔中是二氧化碳与氢氧化钙的反应,所以反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O,故填:Ca(OH)2+CO2=CaCO3↓+H2O
(5)生产过程中二氧化碳由石灰窑中生成,并且参与碳化塔中的反应,所以它是循环使用的物质,故填:CO2。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
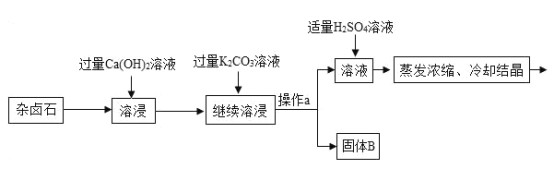
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的___;发生反应的化学方程式是___。
(2)操作a的名称是___。
(3)请写出固体B的两种主要成分___、___(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
a | 25 | 2.5 | 72.4 |
b | 40 | 2.5 | 86.55 |
c | 40 | 3 | 90.02 |
d | 60 | 3 | 91.98 |
e | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是___。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是___℃和Ca(OH)2___g。