题目内容
【题目】金属材料广泛应用于生产生活中。干电池中含有金属铜和锌,将废旧电池回收利用对保护环境具有重要意义。如图是干电池的截面示意图,结合图示回答下列问题:
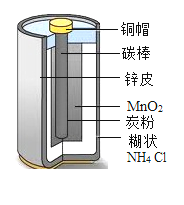
(1)干电池有两个电极,铜帽与碳棒相连为正极,这是利用铜的____________________性。
(2)实验室将废电池回收得到的某金属单质洗净后可用于制取氢气,该反应的化学方程式为____________________。
(3)将电池填充物( MnO2、炭粉及NH4Cl的混合物)加水溶解、过滤,可得到NH4Cl溶液。NH4Cl 还可当作肥料使用,属于____________________肥。
(4)下列能证明铜锌金属活动性强弱的试剂组合是____________________(填字母)。
A.锌、铜和稀硫酸
B.锌和氯化铜溶液
C.铜和硫酸锌溶液
(5)将mgZn和Fe的混合物加入到一-定质量的CuCl2溶液中,充分反应后过滤,将得到的滤渣洗涤、干燥后称量,质量仍为mg,对所得滤液和滤渣有以下四种判断,其中正确的是____________________(填字母)。
A.滤液可能是无色
B.滤液中一定含有ZnCl2和FeCl2
C.滤渣中的物质可能有三种
D.滤渣中加稀盐酸一定有气泡产生
【答案】导电 ![]() 氮 ABC B
氮 ABC B
【解析】
(1)金属铜具有导电性,故填:导电。
(2)铜在金属活动性顺序中是氢后金属,不与酸发生反应,锌是氢前金属、能与酸发生反应。由于盐酸具有挥发性会使氢气不纯,所以实验室制取氢气常用稀硫酸,反应的化学方程式为![]() ,故填:
,故填:![]() 。
。
(3)根据化肥中所含氮、磷、钾元素的种类,化肥可分为氮肥、磷肥、钾肥和复合肥。NH4Cl中只含有氮元素属于氮肥。
(4)两种金属中加酸,根据能否反应,可证明出两者活动性的强弱,能发生反应的活动性强,A符合要求;
证明两种金属的活动性强弱的另一种方法是将其中的一种金属加到另一种金属的盐溶液中。如果能发生反应,说明加入的金属比盐溶液中的金属活动性强,反之则弱。所以选项BC也都能证明二者活动性的强弱。故选ABC。
(5)将锌和铁加到氯化铜的溶液中,优先发生反应的是锌和氯化铜,锌完全反应后才是铁和氯化铜的反应。根据锌和铁与氯化铜发生反应的物质间的质量关系:
![]() 金属质量减少
金属质量减少
![]() 金属质量增加
金属质量增加
可知,锌发生反应后,所得金属的质量比原先质量减少了。铁发生反应后,所得金属的质量比原先增加了。由于反应前后金属的质量没变,那么这两个反应一定都发生了。能确定的是所得金属(滤渣)中一定有铜,一定没有锌,可能有铁。滤液中一定.有氯化锌,氯化亚铁,可能有氯化铜。综上,滤液中一定含有氯化亚铁,滤液为浅绿色,A错误;B正确;滤渣中最多有铜和过量的铁两种金属,C错误;
由于铁可能有也可能没有,所以滤渣加入盐酸不一定有气泡产生,D错误,故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】同学们对市场上烧烤花蛤用的“锡纸”产生了浓厚兴趣。查阅资料获知:市售锡纸也称作铝箔、铝箔锡纸等。那么“锡纸”中的金属是什么呢?
![]()
(猜想与假设)同学们结合金属的颜色、活动性、价格等因素。猜想:可能是锡、铝、镁、铁、中的一种。
(查阅资料)金属锌似晶体状,室温下,锌较硬且相当脆;氧化铝的熔点2054℃;
(初步探究)同学们结合金属的主要的物理和化学特性设计了如下实验:
序号 | 实验方案 | 现象 | 结论 |
1 | _____ | 无明显现象 | 金属不可能是铁 |
2 | 用坩埚钳夹取打磨后的“锡纸”条,放在酒精灯上点燃。 | “锡纸”条熔化但没有滴落,也没燃烧。 | 金属不可能是_____ |
(深入探究)同学们对于“锡纸”到底是什么金属,进行了深入的实验探究。
(1)第一组同学将“锡纸”条卷成和铁钉一样粗细,先在20%的盐酸中浸泡至产生较多气泡,再取蒸馏水清洗,然后浸在蒸馏水中备用。浸泡在盐酸中目的是_____。
(2)将打磨后的铁钉和备用的“锡纸”条分别放入到装有5mL 15% 的稀盐酸中(如图所示)。观察到“锡纸”条表面产生的气泡速率比铁钉快。
(实验结论)制作“锡纸”的金属是_____。写出“锡纸”条与稀盐酸反应的化学方程式:_____。
(交流与反思)
(3)“锡纸”在酒精灯上加热,“锡纸”熔化但没有滴落的原因是:_____。
(4)第二组同学,将备用的“锡纸”条放入到装有硫酸锌溶液的试管中。一段时间后,未观察到明显现象。同学们讨论分析可能的原因是:①反应速率较慢,生成物太少;②_____。
(5)同学们在老师的帮助下,将3克烘干的备用“锡纸”片放入装有硫酸锌溶液的试管中,5分钟后,取出“锡纸”片,洗涤、烘干、称量。反应后金属质量范围是_____。