题目内容
【题目】在实验室加热32.5g二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的质量变化如下图所示。请计算:
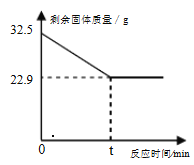
(1)完全反应时,生成氧气的质量为________克。
(2)完全反应后,剩余固体物质是_________(填化学式)。
(3)完全反应后,把剩余固体倒入100g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数为_____________(最后结果保留0.1%)。
【答案】 9.6g KCl和MnO2 13.0%
【解析】本题考查了根据化学方程式的计算。
根据化学方程式和图示可知固体减小的质量是生成氧气的质量,生成的氧气的质量为32.5g-22.9g=9.6g;
由于是完全反应,所以剩余固体为生成的氯化钾和作催化剂的二氧化锰,化学式分别为:KCl和MnO2;
设:生成9.6g的氧气的同时生成的氯化钾的质量为x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
149 96
x 9.6g
![]() x=14.9g
x=14.9g
充分溶解,所得溶液中溶质的质量分数=![]() ×100%≈13.0%。
×100%≈13.0%。

 名校课堂系列答案
名校课堂系列答案【题目】化学能帮助我们更好地认识生活、改善生活。
(1)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 其他 | …… |
① 紫薯中能为人体提供能量的营养物质为脂肪、淀粉和_______;
②以上营养成分中_____(填元素符号,下同)是人体中含有的微量元素,______摄入不足,会导致骨质疏松、佝偻病;
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(2)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的________性;
②高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于________(填字母);
a.金属材料 b.无机非金属材料 c.有机高分子材料
③高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是________(填字母);
a.铜 b.石墨 c.二氧化硅
④基础工程建设中常用到水泥、玻璃、钢材等。在钢材中添加铬、镍等元素的目的是______。