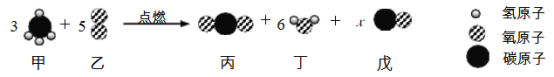题目内容
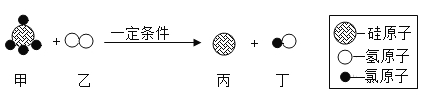
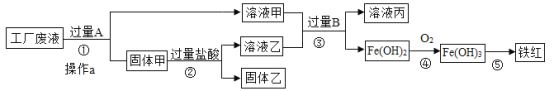
【题目】某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示,
回答下列问题。
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)溶液甲中的金属离子是 (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。
(5)铁红是炼铁的主要原料,写出用CO和铁红炼铁的化学方程式 。
【答案】(5分)(1)引流 (2)Fe+CuCl2= FeCl2+Cu
(3)Na+、Fe2+(4)①②
(5)3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
【解析】
向废水中加入过量的铁,可以把铜还原出来,过滤得到铜、铁.再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;溶液甲中含有溶质氯化亚铁和氯化钠,溶液乙中含有氯化亚铁和盐酸向其加入过量的B,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀.
解:废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和生成的氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.故填:引流.
(2)加入过量的A是铁与氯化铜反应故填:Fe+CuCl2=FeCl2+Cu
(3)溶液甲中含有溶质氯化亚铁和不参加反应的氯化钠;故填Na+、Fe2+
(4)步骤①②③中①是铁和氯化铜反应;②是铁和盐酸反应;③中发生两个反应;氯化亚铁和氢氧化钠反应;盐酸和氢氧化钠反应这两个反应都属于复分解反应,①②中金属与酸、金属与盐的反应都是置换反应;故填①②
(5)铁红(主要成分Fe2O3),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;故填3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2