题目内容
【题目】(8分)A~F均为初中所学的物质。其中属于碱的是B、C,属于盐的是D、E,其中D是钠盐;胃酸中含有F能帮助消化,A是食品包装袋中常用的干燥剂。其物质间的转化关系如图所示。图中“—”表示两端的物质能发生反应;“→”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去。试回答:
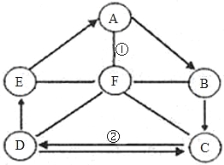
(1)A的俗名是__________________;
(2)写出C物质的化学式__________________________;
(3)写出反应①的化学方程式:_______________________________________;
(4)图中的相互关系中没有涉及的基本反应类型是:__________________________。
【答案】(1)生石灰 (2)NaOH (3)CaO+2HCl=CaCl2+H2O (4)置换反应
【解析】
试题分析:根据题意可知:胃酸中含有F能帮助消化,所以F为盐酸;A是食品包装袋中常用的干燥剂,为氧化钙。E为盐,且E→A;则E为碳酸钙。A→B,且B为碱;所以B为氢氧化钙。CD可相互转化,且D为钠盐,则C中应含钠元素。又知C为碱,所以C 为氢氧化钠。D→E,又知E为碳酸钙;所以D为碳酸钠。
(1)A为氧化钙,其俗名是生石灰;
(2)C为氢氧化钠,其化学式为NaOH;
(3)反应①为盐酸与氧化钙的反应,所以反应的化学方程式为:CaO+2HCl=CaCl2+H2O
(4)基本反应类型有分解、化合、置换和复分解。E→A为碳酸钙在高温下反应生成氧化钙和二氧化碳,为分解反应。A→B为氧化钙和水反应生成氢氧化钙,为化合化合反应。其他反应均为复分解反应。所以未出现的基本反应类型为置换反应。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】(6分)课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
蒸发皿的质量(g) | 25.0 |
蒸发皿+食盐溶液(g) | 45.0 |
蒸发皿+食盐晶体(g) | 27.4 |
数据处理 | 溶液的溶质质量分数为 |
若化学方法测定结果准确,则物理方法测定结果产生误差的原因是
A.蒸发时未用玻璃棒搅拌 B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热 D.实验后未将玻璃棒上的白色固体移入蒸发皿