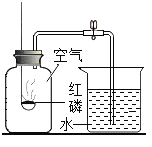
题目内容
【题目】图中表示的是几种常见物质的转化关系(部分反应物、生成物及反应条件省略),已知C为生活中不可缺少的调味品,F为某种建筑材料的主要成分,请回答以下问题:
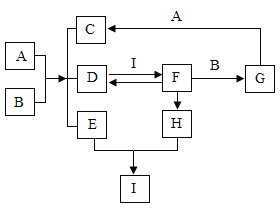
(1)写出E的化学式__;
(2)写出F和B反应的化学方程式__;
(3)写出D和I的溶液反应的现象__;
(4)写出I的一种用途__.
【答案】H2O CaCO3+2HCl═CaCl2+H2O+CO2↑ 溶液变浑浊 改良酸性土壤
【解析】
C为生活中不可缺少的调味品,故C是氯化钠;F为某种建筑材料的主要成分,可以是碳酸钙;D能和F相互转化;故D可能是二氧化碳;I能和D反应生成碳酸钙,故I可能是氢氧化钙;A和B能反应生成三种物质,且生成了二氧化碳,故A和B的反应可能是碳酸盐和酸的反应;碳酸钙能与B反应,故B可能是盐酸,A可能是碳酸钠;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,G能与碳酸钠反应,故G可能是氯化钙,生成的C是氯化钠;故E是水;碳酸钙高温能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,带入框图,推断合理;
(1)E是水,故填:H2O;
(2)F是碳酸钙,B是盐酸,盐酸能与碳酸钙反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)D是二氧化碳,I是氢氧化钙,二氧化碳与氢氧化钙反应生成白不溶于水的碳酸钙沉淀,使溶液变浑浊,故填:溶液变浑浊;
(4)I是氢氧化钙,具有碱性,可以用于改良酸性土壤,故填:改良酸性土壤.

 阅读快车系列答案
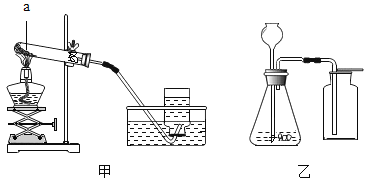
阅读快车系列答案【题目】某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出一定量的溶液作为待测液进行如下探究.
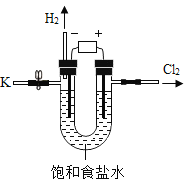
老师提示:
I.电解饱和食盐水的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
实验步骤 | 实验现象 | 实验结论 |
____________________ | ________________ | 待测液中含有氢氧化钠. |
探究活动二:测定待测液中氢氧化钠的质量分数
(实验1)用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(2)写出待测液中的氢氧化钠与稀盐酸反应的化学方程式:________________________.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据计算所称取待测液中氢氧化钠的质量时,应选用稀盐酸的体积为_______________mL.
(实验2)用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
取待测液称重 ②加入足量氯化镁溶液 ③过滤出沉淀物 ④洗涤沉淀 ⑤干燥称重
乙组同学按如图所示的实验步骤进行实验:
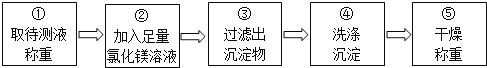
(4)步骤②加入的氯化镁溶液必需足量,其目的是____________________.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:___________________________(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是____________.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将 ________(选填“偏大”、“偏小”或“没影响”).