题目内容
【题目】某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出一定量的溶液作为待测液进行如下探究.
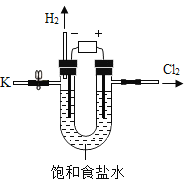
老师提示:
I.电解饱和食盐水的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
实验步骤 | 实验现象 | 实验结论 |
____________________ | ________________ | 待测液中含有氢氧化钠. |
探究活动二:测定待测液中氢氧化钠的质量分数
(实验1)用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(2)写出待测液中的氢氧化钠与稀盐酸反应的化学方程式:________________________.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据计算所称取待测液中氢氧化钠的质量时,应选用稀盐酸的体积为_______________mL.
(实验2)用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
取待测液称重 ②加入足量氯化镁溶液 ③过滤出沉淀物 ④洗涤沉淀 ⑤干燥称重
乙组同学按如图所示的实验步骤进行实验:
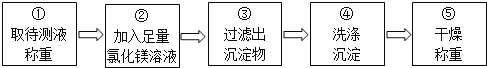
(4)步骤②加入的氯化镁溶液必需足量,其目的是____________________.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:___________________________(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是____________.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将 ________(选填“偏大”、“偏小”或“没影响”).
【答案】向待测液中滴加几滴酚酞试液 酚酞试液变红色 NaOH+HCl═NaCl+H2O 9.8 使氢氧化钠完全反应 取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量 氢氧化镁 偏大
【解析】
氢氧化钠溶液显碱性,能使酚酞试液变红色,氢氧化钠和稀盐酸反应生成氯化钠和水,向氢氧化钠溶液中滴加稀盐酸时,溶液的碱性减弱,pH减小,当pH=7时,氢氧化钠和稀盐酸恰好完全反应,氢氧化钠和氯化镁反应生成氯化钠和氢氧化镁,
(1)氢氧化钠溶液显碱性,能使酚酞试液变红色。
实验步骤 | 实验现象 | 实验结论 |
向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液中含有氢氧化钠. |
(2)氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式为NaOH+HCl=NaCl+H2O。
(3)氢氧化钠和稀盐酸恰好完全反应时,溶液的pH=7,故利用氢氧化钠与稀盐酸恰好完全反应时的实验数据计算所称取待测液中氢氧化钠的质量时,应选用稀盐酸的体积为9.8mL。
(4)氢氧化钠和氯化镁反应生成氯化钠和氢氧化镁,故步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应。滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量。
(5)氢氧化钠和氯化镁反应生成氯化钠和氢氧化镁沉淀,故步骤③过滤出的沉淀物是氢氧化镁。
(6)利用沉淀物的质量计算氢氧化钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
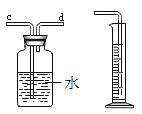
同步拓展阅读系列答案【题目】实验室有一瓶标签受到腐蚀的无色溶液,如图所示:
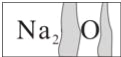
这瓶无色溶液是放在存放盐溶液的柜子里。化学兴趣小组开展探究:
【提出问题】这瓶无色溶液究竟是什么盐的溶液?
【猜想与假设】该无色溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
【初步分析】
(1)库尔班同学根据标签上的组成元素认为一定不是 溶液。
(2)艾力同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是 。
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验:
实验操作 | 实验现象 |
①取少重该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀全部溶解 |
【实验结论】
(3)该瓶无色溶液的溶质是 (填化学式),生成白色沉淀的化学反应方程式是 。
【实验反思】
(4)玉素甫同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实验操作 | 实验现象 |
(5)白燕同学经查阅资料得知:氯化钠、硫酸钠、硝酸钠溶液呈中性,碳酸钠、碳酸氢钠溶液呈碱性,提出测溶液的酸碱性来确定更简便。她采用 测量溶液的pH值 7(填>、=、<),则结论与以上同学一致。
【题目】甲、乙、丙三种物质间通过一步反应能实现右图转化,下列选项中符合图示转化关系的是
选项 | 甲 | 乙 | 丙 |
A | NaOH | NaCl | NaNO3 |
B | CuO | CuCl2 | Cu(OH)2 |
C | Na2CO3 | CO2 | CaCO3 |
D | H2O2 | H2O | O2 |
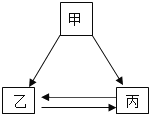
A. A B. B C. C D. D