��Ŀ����
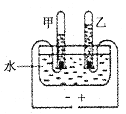
����Ŀ��ʵ��������ͼ1��ʾ�b�õIJ��ֻ�ȫ����Ϻ��������ʵ�飬��ش��������⡣
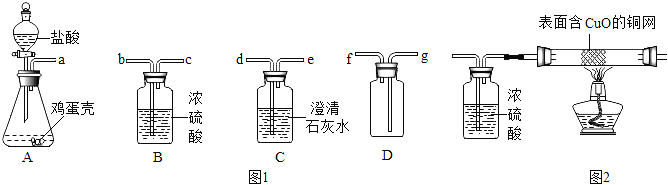
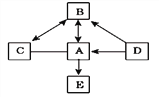
��1�������ǵ���Ҫ�ɷ���̼��ƣ�Aװ���з������õĻ�ѧ����ʽΪ_____��A��C������C�е�����Ϊ_____��
��2������Aװ���е�ҩƷ����ϡ�����п����������H2���������Dװ���ռ�����Dװ�õ�ƿ������ʱ�����ܿڵ�����˳��Ӧ��a��b��c��_____��
��3������Aװ���е�ҩƷ��������ͭ��Һ�����ۣ��������ɺ�ɫ�������ʵ�ͬʱ�н϶�����ݷų�����ʦ��ʾ���÷�Ӧ���ɵ�����ֻ��һ�֡�
�����룩�ų������������SO2��O2��H2�е�һ�֣���������������_____��
�����ϣ�S02������ˮ����ѧ�����������̼���ƣ���ʹ����ʯ��ˮ����ǣ�����CaS03��
�������������������룬ʵ��С��ͬѧ�ֱ���������·�����
�ټ�ͬѧ��Ϊ��O2������鷽����_____��
����ͬѧ��Ϊ��S02����ֻ�轫װ��A��C������������ʯ��ˮ�Ƿ����Ǽ��ɡ�д��SO2��Ca��OH��2��Ӧ�Ļ�ѧ����ʽ��_____��
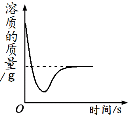
�۱�ͬѧ����ͬѧʵ��װ�õĻ�������������ͼ2��ʾ��װ�ã��۲쵽�Թ��в�����������_____��
�����ۣ�����ʵ�飬�ó����ۣ��ų�������ΪH2��
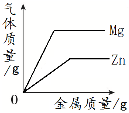
��4����������ԭ����ͭ��ʵ���У���50g����ͭ��ĩ��ͨ����������һ��ʱ���÷�Ӧ������ˮ������Ϊ9g�����ѷ�Ӧ��������ͭ������________��
���𰸡� CaCO3+2HCl�TCaCl2+H2O+CO2���� �����ʯ��ˮ����ǣ� g�� �����غ㶨�ɣ� �����ǵ�ľ�����飬��ľ���Ƿ�ȼ�� SO2+Ca��OH��2=CaSO3��+H2O�� ͭ������ĺ�ɫ���ʱ�죻 �ѷ�Ӧ��������ͭ������Ϊ40g��
��������������ѧ֪ʶ��������Ϣ֪����1�������ǵ���Ҫ�ɷ���̼��ƣ�Aװ���з������õĻ�ѧ����ʽΪCaCO3+2HCl�TCaCl2+H2O+CO2����A��C������C�е�����Ϊ�����ʯ��ˮ����ǣ�������̼������ʯ��ˮ��Ӧ���ɰ�ɫ����̼��ơ���2������Aװ���е�ҩƷ����ϡ�����п����������H2���������Dװ���ռ�����Dװ�õ�ƿ������ʱ�����ܿڵ�����˳��Ӧ��a��b��c��g��Ũ���������ˮ�ԣ������ܶȱȿ���С����3������Aװ���е�ҩƷ��������ͭ��Һ�����ۣ��������ɺ�ɫ�������ʵ�ͬʱ�н϶�����ݷų����÷�Ӧ���ɵ�����ֻ��һ�֡�����ͭ���ã���������ͭ��Һ��Ӧ��������������ͭ�������롿�ų������������SO2��O2��H2�е�һ�֣��������������������غ㶨�ɣ��κ�һ����ѧ��Ӧ����Ȼ��ѭ�����غ㶨�ɡ���������������·������ټ���Ϊ��O2������鷽���Ǵ����ǵ�ľ�����飬��ľ���Ƿ�ȼ����������ʹ�����ǵ�ľ��ȼ�ա�������Ϊ��S02����ֻ�轫װ��A��C������������ʯ��ˮ�Ƿ����Ǽ��ɡ�SO2��Ca��OH��2��Ӧ�Ļ�ѧ����ʽ��SO2+Ca��OH��2=CaSO3��+H2O��S02������ˮ����ʹ����ʯ��ˮ����ǣ����ɲ�����ˮ��CaS03���۱�����ʵ��װ�õĻ�������������ͼ2��ʾ��װ�ã��۲쵽�Թ��в�����������ͭ������ĺ�ɫ���ʱ�죬����������л�ԭ�ԣ�������ͭ��ԭΪͭ�������ۡ��ų�������ΪH2��
��4��������ѷ�Ӧ��������ͭ������Ϊx
H2 + CuO�� Cu + H2O
80 18
x 9g
![]() ��
��![]() ,x��40g��
,x��40g��
�㾦������һ���ۺ��⣬S02������ˮ����ѧ�����������̼���ƣ���ʹ����ʯ��ˮ����ǣ�����CaS03 ��ɫ����������ͭ���ã���������ͭ��Һ��Ӧ��������������ͭ��

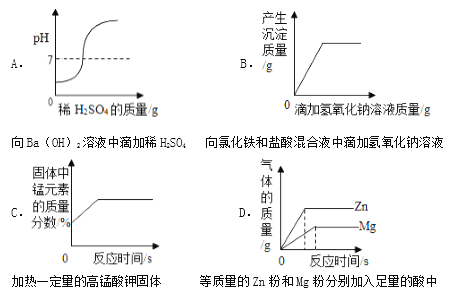
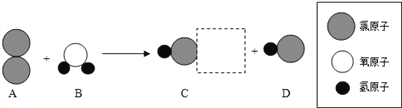
����Ŀ�������ĸ�ͼ���У�����ȷ��ӳ��Ӧ�仯��ϵ����
|
|
|
|
A����һ����������������Һ����μ���pH = 2��ϡ���������� | B��ij�¶�ʱ����һ�����ı���ʯ��ˮ�м���������ʯ�� | C����������ȫ��ͬ��ϡ�����зֱ����п�ۡ�þ�� | D����ˮͨ��һ��ʱ�� |
����Ŀ��ijЩʳƷ�İ�װ���ڣ�����װ�а�ɫ����״�����Сֽ��������д�š����������Ҫ�ɷ�Ϊ��ʯ�ҡ���ijͬѧ��һ�����ÿ����еĸ����������̽����
����ȡ���־��ø������������ˮ�У���ֽ��衢����,�õ���ɫ�������Һ��Ȼ�����Һ������ԺͰ�ɫ������������̽����
��ʵ��̽��һ��̽����Һ�������
��ͬѧ�ⶨ����Һ������ԣ�����Ϊ����Һ��____________�ԡ�
��ʵ��̽������̽�����˺��ɫ��������
��ͬѧ��Ϊ��ɫ�����п��ܺ��е�������CaO��Ca(OH)2��CaCO3��
�������й����ϵ�֪��CaO��һ�ְ�ɫ���壬�׳���ʯ�ң�����ˮ��Ӧ�����������ƣ����ų�������������������ˮ��
�������жϣ�����Ϊ�ù��˺�õ��İ�ɫ������һ�������е�������_______��
��ʵ������������Ǹ�ͬѧ��ƵĽ�һ��̽����ɫ������ɵ�ʵ�鷽�����������һ�����ʵ�鱨�档
ʵ����� | ʵ������ | ʵ����� |
��ȡ������ɫ���壬��������ˮ����ֽ��衢���ã� �����ϲ���Һ�еμ���ɫ��̪��Һ | �ϲ���Һ��____ɫ | ��ɫ������һ�������������� |
��ȡ������ɫ��������Թ��У��μ�ϡ���� | _________ | ��ɫ������һ������̼��� |
���ܽᷴ˼��
ֻͨ������ʵ�飬������֤����������ڿ����еĸ�������Ƿ���CaO���������һ��֤�����������к��н϶���CaO�ļ���ʵ�飺____���û�ѧ����ʽ��ʾ���еķ�Ӧ_____��
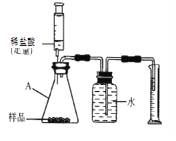
��ʵ��̽������̽���������Ʒ��̼��Ƶ���������
ȡ�����������Ʒ10g������ͼ��װ���У���ַ�Ӧ�������Ͳ�е�ˮ�����Ϊ220mL,(��״���¶�����̼���ܶ���2g/L),��˸������̼��Ƶ���������Ϊ___________(ͨ��������գ�
���ܽᷴ˼����ʵ��̽��������ʵ����ƵIJ�����֮��_________