题目内容
【题目】金属和金属材料在生活、生产中应用广泛。
(1)铁在潮湿的空气中容易生锈,实际上是与空气中的_____、_____等发生了化学反应。
(2)用Fe、Ag和_____溶液(填序号),可以一次性验证Fe、Cu、Ag三种金属的活动性顺序。写出有关反应的化学方程式_____。
①AgNO3溶液 ②CuSO4溶液 ③Al2(SO4)3溶液
(3)某汽修厂清洗汽车零件后的废液中常含有一定量的AgNO3和Cu(NO3)2,向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤液中加入稀盐酸,没有白色沉淀产生,下列叙述正确的是_____(填序号)
A 滤渣中一定没有Fe
B 滤液中一定有Fe(NO3)2和Cu(NO3)2
C 滤渣中一定有Ag,可能有Cu
D 滤液中一定有Fe(NO3)2,一定没有AgNO3
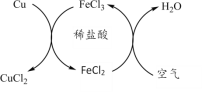
(4)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图:

请写出第③步反应的化学方程式_____。
【答案】水 氧气 ② Fe+CuSO4═FeSO4+Cu CD Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【解析】
(1)铁在潮湿的空气中容易生锈,实际上是与空气中的水、氧气等发生了化学反应。
(2)用Fe、Ag和硫酸铜溶液,可以一次性验证Fe、Cu、Ag三种金属的活动性顺序,这是因为银不能和硫酸铜反应,说明铜比银活泼,铁能和硫酸铜反应生成生成硫酸亚铁和铜,说明铁比铜活泼,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
(3)由于金属的活动性是:铁>铜>银,向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,铁首先与硝酸银反应生成硝酸亚铁和银,当硝酸银反应完全后,铁再与硝酸铜反应生成硝酸亚铁和铜。充分反应后过滤,向滤液中加入稀盐酸,没有白色沉淀产生,说明了溶液中不存在硝酸银。
A、铁粉的量置换出银和铜后还有剩余时,滤渣中则含有铁,现象也为没有白色沉淀产生,故选项错误;
B、溶液中不存在硝酸银,则滤液中一定有Fe(NO3)2,但是否存在Cu(NO3)2无法判断,故选项错误;
C、滤渣中一定有Ag,可能有Cu,故选项正确;
D、滤液中一定有Fe(NO3)2,一定没有AgNO3,故选项正确。故选CD。
(4)第③步中氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

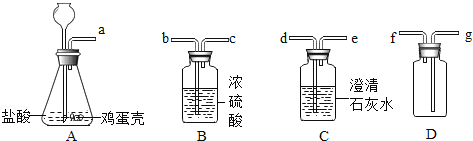
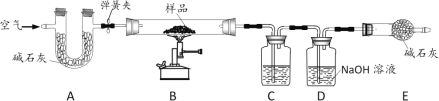
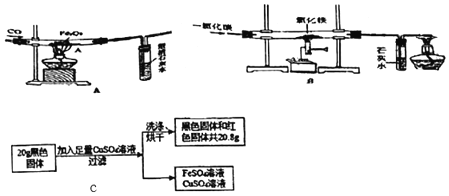
【题目】杨敏在实验室进行CO还原氧化铁的实验采用酒精灯加热(图A)与书本实验(图B)现象相同,发现在得到的黑色粉末中加稀盐酸,没有气泡产生,杨敏就图A实验中反应后得到的黑色粉末的成分进行了如下探究。
(查阅资料)①铁粉及铁的几种常见氧化物的颜色及部分性质。
物质 | 铁粉 | Fe2O3 | Fe3O4 | FeO |
颜色 | 黑色 | 红棕色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 能 | 不能 |
②实验室酒精灯的温度为400﹣500℃,酒精喷灯的加热温度在1000℃左右。
③当温度高于300℃以上,Fe2O3容易被还原成Fe3O4;当温度高于600℃以上,Fe3O4容易被还原FeO;当温度高于700℃以上,FeO容易被还原成Fe;
(提出问题)图A实验得到黑色粉末的成分是什么?
(提出猜想)黑色粉末的成分是:①FeO、Fe3O4②FeO③Fe3O4;④FeO、Fe3O4、Fe2O3。
(分析与评价)猜想_____错误,理由是_____。
(1)装置A有一处明显错误,该错误是_____。
(2)请写出澄清石灰水中发生的反应的化学方程式_____。
(3)由对比实验可知,还原氧化铁的实验产物与_____有关。
(实验设计)将图A实验得到黑色粉末倒在一表面皿中,用磁铁接触黑色粉末,出现_____现象,说明猜想②正确。
(4)实验B最后得到的黑色固体可能是Fe和Fe3O4,中的一种或两种。小海设计如下实验探究其成分,请帮助他完成该探究过程。
(探究过程)①定性研究:取少量的图B实验得到的黑色粉末于一试管中,加入适量的硫酸铜溶液,充分振荡,出现_____现象,证明黑色固体中有铁。
②定量研究:取B实验得到的黑色固体20g,设计如图C实验:试推测黑色固体的成分是_____。
③有同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)_____(填“行”或“不行”)理由是_____。
【题目】马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
加入稀盐酸的质量/g | 生成气体的总质量/g | |
第1次 | 20 | 1.1 |
第2次 | 20 | 2.2 |
第3次 | 20 | m |
第4次 | 20 | 4.4 |
第5次 | 20 | 4.4 |
(1)m的值为_________g
(2)12g石灰石样品中碳酸钙的质量等于_________g
(3)反应完全后最终溶液中氯化钙的质量分数为_______?(写出计算过程,计算结果精确至0.1)