题目内容
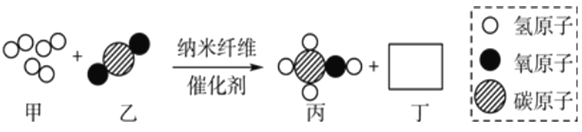
【题目】甲和乙可以合成清洁燃料丙,微观过程如图。下列说法错误的是
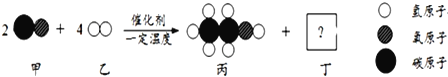
A. 丁的化学式为H2O B. 丙中C、H、O的质量比为12:3:8
C. 该反应中有三种氧化物 D. 参加反应的甲和乙的质量比是7:1
【答案】C
【解析】甲物质的化学式为CO、乙物质的化学式为H2、丙物质的化学式为C2H6O,结合质量守恒定律化学反应前后原子的种类和个数都不变可知丁的化学式为H2O,因此反应的方程式为:2CO+4H2 ![]() C2H6O+H2O,因此:
C2H6O+H2O,因此:
A、丁的化学式为H2O,故说法正确;
B、丙是C2H6O,其中C、H、O的质量比为(12×2 ):(1×6):16=12:3:8,故说法正确;
C、由方程式可知,该反应中有CO、H2O两种氧化物,故说法不正确;
D、由方程式可知,参加反应的甲和乙的质量比是:【2×(12+16)】:【4×1×2】=7:1,故说法正确。

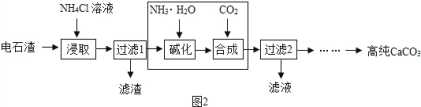
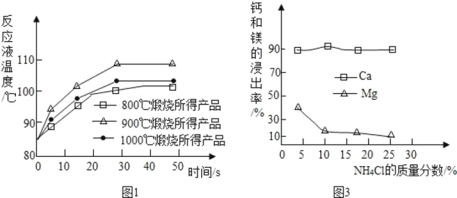
【题目】化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊。
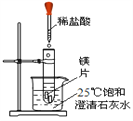
(一)石灰水变浑浊的原因是:
(1)镁和盐酸的反应________(填“吸热”或“放热”)。
(2)_____________________________________________。
(二)甲同学测得反应后试管内溶液pH<7 ,该溶液pH<7的可能原因是:
①MgCl2溶液的pH<7; ②__________________________。
(三)乙同学将反应后试管内溶液冷却,加入镁粉并滴入酚酞,溶液颜色无变化,再加热,发现溶液慢慢浑浊且变红。
【猜想】对实验中“溶液慢慢浑浊且变红”的原因,乙同学提出猜想:
MgCl2+2H2O=Mg(OH)2↓+2HCl,大家都认为此猜想不合理,理由是_________。
【查阅】资料1:Mg(OH)2难溶解于水,升高温度可加大其在水中的溶解度。
资料2:K、Ca、Na、Mg等活泼金属在一定条件下能与水反应,产生碱和气体。
【实验】乙同学重新在滴有酚酞的热水中加入镁粉,观察到液体慢慢变红并浑浊,镁粉表面产生气泡。收集并点燃气体,发现能燃烧。乙同学实验中“溶液慢慢浑浊且变红”的原因请用化学方程式表示:___________________。
(四)丙同学在做实验时,不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物。他非常好奇,进行了如下探究。
【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么?
【查阅资料】
Mg(OH)2 | MgCO3 | |
溶解性 | 难溶于水 | 微溶于水 |
热稳定性 | 受热易分解,能生成两种氧化物 | 受热易分解,能生成两种氧化物 |
实验探究一:镁条与碳酸氢钠溶液反应产生什么气体呢?
猜想 | 实验方法 | 现象 | 结论 | |
① | 二氧化碳 | 收集气体于集气瓶中,而后将气体通入澄清石灰水中; | 无明显现象 | 猜想①不成立 |
② | 氧气 | 收集气体于集气瓶中,而后将________放入瓶中; | 无明显现象 | 猜想②不成立 |
③ | 氢气 | 第一步,点燃产生的气体; 第二步,在火焰上罩内壁涂有石灰水的烧杯。 | 气体能被点燃; 烧杯内壁无现象; | 猜想______成立 (填序号) |
④ | _____ | |||
⑤ | 甲烷 | |||
实验探究二:
【提出问题】镁条与碳酸氢钠溶液反应,产生的白色不溶物是什么?
【作出猜想】丙同学根据资料分析认为白色不溶物可能是Mg(OH)2和MgCO3中的一种或两种。
【进行实验】
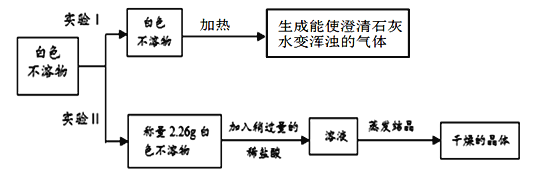
(1)根据实验Ⅰ的现象,写出加热白色不溶物时一定发生的化学反应的方程式__________;
(2)实验Ⅱ中 称量“干燥的晶体”质量为2.85g,由此通过计算确定白色不溶物是成分是_________________。(请你写出计算过程)