题目内容
为检查某石灰石样品中碳酸钙的纯度,取该样品24g放入烧杯中,再向烧杯中加入70g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共85.2g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量分数。
(1)8.8g
(2)83.3%
解析试题分析:根据题意,石灰石样品与稀盐酸反应,生成氯化钙、水和二氧化碳,故反应的化学方程式为CaCO3+ 2HCl=CaCl2+H2O+CO2↑,依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的二氧化碳的质量;利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。
(1) 反应生成CO2的质量=24g+70g-85.2g==8.8g
(2)解:设石灰石样品中CaCO3的质量x 。
2HCl+CaCO3=CaCl2+H2O+CO2↑
100 44
x 8.8g
x =20g
20g/24g×100%==83.3%
答:石灰石样品中碳酸钙的质量分数是83.3%。
考点:根据化学反应方程式的计算

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

 Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?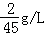 .试求:
.试求: