题目内容
(10分)将5%的NaOH溶液逐滴加入到10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。边回答:
(1)a点溶液中大量存在的离子有______________。
(2)当恰好完全反应时,消耗NaOH溶液的质量为__________。
(3)计算稀盐酸中溶质的质量分数。
(1)钠离子、氯离子(Na+、Cl—)
(2)16g。
(3)7.3%。
解析试题分析:(1)题目中的的反应为氢氧化钠与盐酸反应生成氯化钠和水。根据题意可知:a点表示加入的氢氧化钠过量。所以溶液中含氢氧化钠(过量)和反应生成的氯化钠;则含钠离子、氢氧根离子和氯离子。其中氢氧根离子的量较小。所以应为钠离子和氯离子。
(2)当恰好完全反应时,溶液呈中性,PH等于7。此时消耗NaOH溶液的质量为16g。
(3)已知量为加入的氢氧化钠的质量,未知量为稀盐酸中溶质的质量分数。解题思路:可根据氢氧化钠与纯盐酸的质量关系进行求解。具体过程如下:
解:加入氢氧化钠的质量为16g×5%=0.8g
设稀盐酸中溶质的质量分数为x
HCl+NaOH==NaCl+H2O
36.5 40
10gx 0.8g
36.5:40=10gx:0.8g
x=7.3%
答:稀盐酸中溶质的质量分数为7.3%。
考点:综合计算

将100g质量分数为0.05%的食盐溶液改变成质量分数为0.10%,则下列操作可行的是
| A.加入5g食盐 | B.蒸发掉50g水 |
| C.加入50g食盐 | D.取出50g溶液即可 |
将一瓶盐酸分别倒入两只大烧杯中,将烧杯放在天平两边,并调节天平到指针指在分度盘中间,然后在左盘的烧杯中加10g碳酸钙,在右盘的烧杯中加入10g碳酸钠,待烧杯中固体物质完全消失后,天平指针( )
| A.仍在中间 | B.偏向左盘 | C.偏向右盘 | D.无法确定 |
我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: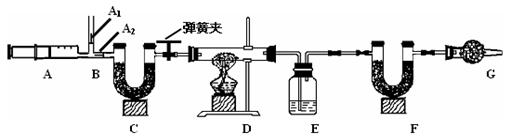
已知:1.碳酸钠比较稳定,加热时不分解 ;2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
实验步骤
实验时,组装好装置,实验前应先 ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反
应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。
