题目内容
【题目】在化学变化中,物质的转化遵循质量守恒定律。一定质量的某物质甲(相对分子质量是90)在氧气中完全燃烧,消耗6.4g氧气,同时生成5.6g一氧化碳、4.4g二氧化碳和5.4g水,则对甲的说法正确的是( )
A.只含有碳、氢两种元素B.一定含有碳、氢元素,可能含有氧元素
C.碳元素质量分数为60%D.若相同质量的甲在9.6g氧气中完全燃烧,则只生成二氧化碳和水
【答案】D
【解析】
A、从反应前后元素种类不变只能得出甲中一定含有碳、氢,可能含氧元素,A说法不正确.
B、5.6g一氧化碳中氧元素的质量为5.6g×![]() ×100%=3.2g,4.4g二氧化碳中氧元素的质量为4.4g×
×100%=3.2g,4.4g二氧化碳中氧元素的质量为4.4g×![]() ×100%=3.2g,5.4g水中氧元素的质量为5.4g×
×100%=3.2g,5.4g水中氧元素的质量为5.4g×![]() ×100%=4.8g,根据质量守恒定律反应前后氧元素的质量不变,反应后氧元素的总质量为3.2g+3.2g+4.8g=11.2g>6.4g,所以反应物甲中含有氧元素,氧元素的质量为11.2g-6.4g=4.8g.B说法不正确.
×100%=4.8g,根据质量守恒定律反应前后氧元素的质量不变,反应后氧元素的总质量为3.2g+3.2g+4.8g=11.2g>6.4g,所以反应物甲中含有氧元素,氧元素的质量为11.2g-6.4g=4.8g.B说法不正确.
C、5.6g一氧化碳中碳元素的质量为5.6g×![]() ×100%=2.4g,4.4g二氧化碳中碳元素的质量为1.2g,所以生成物中碳元素一共3.6g,根据质量守恒定律这与参加反应的甲中碳元素的质量相等,所以甲中碳元素的质量分数为
×100%=2.4g,4.4g二氧化碳中碳元素的质量为1.2g,所以生成物中碳元素一共3.6g,根据质量守恒定律这与参加反应的甲中碳元素的质量相等,所以甲中碳元素的质量分数为![]() ×100%=40%,C错误.
×100%=40%,C错误.
D、设甲的化学式为CxHyOz,则![]() ×100%=40%,x=3;氧元素的质量分数为
×100%=40%,x=3;氧元素的质量分数为![]() =
=![]() ,z=3;根据甲的相对分子质量12×3+y+16×3=90,z=6;所以甲的化学式为C3H6O3,燃烧的化学方程式为C3H6O3+3O2
,z=3;根据甲的相对分子质量12×3+y+16×3=90,z=6;所以甲的化学式为C3H6O3,燃烧的化学方程式为C3H6O3+3O2![]() 3CO2+3H2O,所以甲和氧气反应生成二氧化碳和水时甲和氧气的质量比为90:96,所以D说法正确.
3CO2+3H2O,所以甲和氧气反应生成二氧化碳和水时甲和氧气的质量比为90:96,所以D说法正确.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
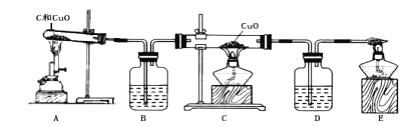
小学教材完全解读系列答案【题目】实验室常用的制备气体的部分装置如图所示,请根据要求完成问题.
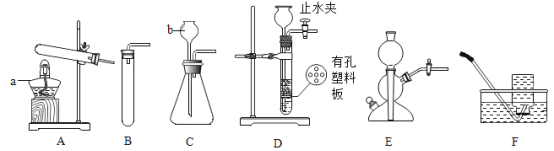
① 写出图中编号仪器的名称:a____,b___________
② 用装置A制取氧气的化学方程式_______________________,若用装置F收集氧气,判断氧气集满的方法是____________________;若在反应结束时未及时将导管移出水面熄灭酒精灯,可能发生的后果是___________________.
③ 某班级学生通过实验确定制取二氧化碳的原料.
试管编号 | 实验步骤 | 现象 | 结论 | |
甲 | 稀盐酸中放入粉末状碳酸钠 | 反应剧烈 | 产生大量气泡 | 选择_________为原料最合适,该反应的化学方程式是______ |
乙 | 稀盐酸中放入粉末状碳酸钙 | |||
丙 | 稀盐酸中放入块状碳酸钙 | 反应____ | ||
上图中均可用于实验制取CO2的发生装置有________________(填写上图字母序号)。检验CO2气体常用澄清石灰水,有关化学方程式是______________________.
④ 实验室用锌粒和稀硫酸可以在装置E中制取氢气,反应中关闭活塞K,反应就会自行停止的原因是__________________________________。
⑤ 装置A~E中导气管都只伸出橡皮塞一点点的原因是_______________________。
⑥ 某同学把足量蜡烛在如图密闭的集气瓶内燃烧至熄灭。用仪器测出瓶内氧气含量的变化如图所示。判断正确的是_______________________。
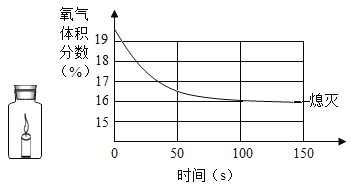
A蜡烛熄灭后瓶内只剩二氧化碳气体
B实验过程中既有物理变化,又有化学变化
C该过程中瓶内物质总质量不断减少
D氧气浓度小于一定值时,蜡烛无法燃烧