题目内容
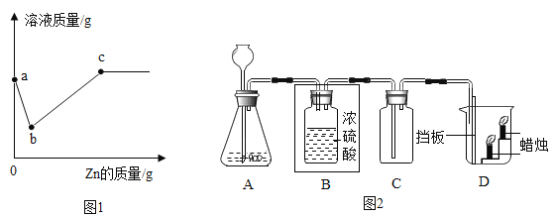
【题目】如图为四种粒子的结构示意图,根据图示回答有关问题:
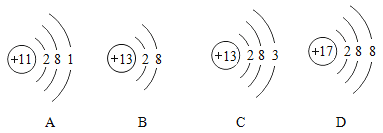
(1)写出其中属于阴离子的离子符号________。
(2)元素M形成的氧化物为M2O3,则M的原子结构示意图可能是________(填字母序号)。
(3)铝制品形成致密保护膜的化学方程式是_____。
【答案】Cl- C 4Al+3O2=2Al2O3
【解析】
(1)在阴离子中,质子数<核外电子数,所以D粒子属于阴离子,核内质子数为17,核外有18个电子,所以是带有1个单位负电荷的氯离子,符号为:Cl-;
(2)根据某元素M形成的氧化物为M2O3,可推断出M元素的化合价为+3,因为元素的正化合价数等于其原子的最外层电子数,由此可知:M的原子最外层电子数为3,原子结构示意图可能是 C;
(3)铝和氧气在常温下生成氧化铝,化学方程式为:4Al+3O2=2Al2O3。
故答案为:
(1)Cl-;
(2)C;
(3)4Al+3O2=2Al2O3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如下:
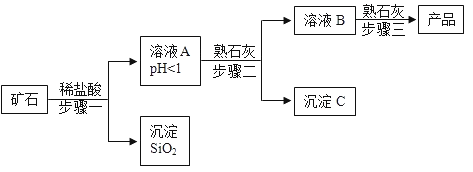
(1)溶液A中所含的阳离子有_______________(填离子符号)。
(2)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
步骤二中加入熟石灰,调节溶液的pH范围为______________。
(3)3个步骤中均用到的操作是_________________。
(4)步骤三中生成产品的化学方程式为___________。
【题目】如图是A、B两种固体(不含结晶水)物质的溶解度曲线,依图回答:
①____℃时,A、B两物质的溶解度相等;
②t1℃时,将A、B各m g分别加到均盛有50g水的两只小烧杯中,充分搅拌后,若其中有一个烧杯中有固体剩余,则该物质是____(填“A”或“B”);
③t3℃时,A物质饱和溶液的溶质的质量分数为____;在不改变溶质质量分数的情况下,将该A的饱和溶液变为不饱和溶液的方法是____;
④烧杯中盛有一定质量、温度为80℃、溶质为A的溶液,将其置于室温环境中,测定不同温度时析出固体A的质量.测定结果记录如下表.
溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
析出固体A的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
不考虑水蒸发,则65℃时,该溶液是否为饱和溶液?____(填“是”、“否”或“无法判断”).
⑤根据如图A、B两种固体物质的溶解度曲线,下列说法错误的是____.
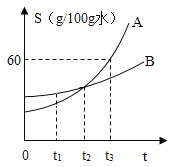
A t2℃时,A、B两物质的溶液中所含的溶质相同
B t2℃时,A、B饱和溶液的溶质质量分数相同
C t3℃时,A、B的饱和溶液降温至t2℃,A 析出的固体比B多
D t3℃时,A、B的饱和溶液降温至t2℃,A、B所含的溶剂质量不变.