题目内容
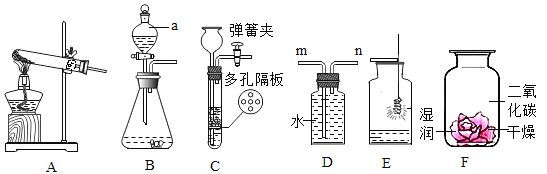
【题目】实验室常用的制备气体的部分装置如图所示,请根据要求完成问题.
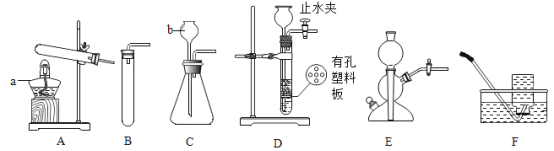
① 写出图中编号仪器的名称:a____,b___________
② 用装置A制取氧气的化学方程式_______________________,若用装置F收集氧气,判断氧气集满的方法是____________________;若在反应结束时未及时将导管移出水面熄灭酒精灯,可能发生的后果是___________________.
③ 某班级学生通过实验确定制取二氧化碳的原料.
试管编号 | 实验步骤 | 现象 | 结论 | |
甲 | 稀盐酸中放入粉末状碳酸钠 | 反应剧烈 | 产生大量气泡 | 选择_________为原料最合适,该反应的化学方程式是______ |
乙 | 稀盐酸中放入粉末状碳酸钙 | |||
丙 | 稀盐酸中放入块状碳酸钙 | 反应____ | ||
上图中均可用于实验制取CO2的发生装置有________________(填写上图字母序号)。检验CO2气体常用澄清石灰水,有关化学方程式是______________________.
④ 实验室用锌粒和稀硫酸可以在装置E中制取氢气,反应中关闭活塞K,反应就会自行停止的原因是__________________________________。
⑤ 装置A~E中导气管都只伸出橡皮塞一点点的原因是_______________________。
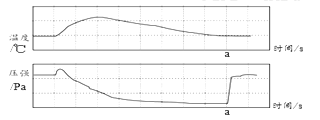
⑥ 某同学把足量蜡烛在如图密闭的集气瓶内燃烧至熄灭。用仪器测出瓶内氧气含量的变化如图所示。判断正确的是_______________________。
A蜡烛熄灭后瓶内只剩二氧化碳气体
B实验过程中既有物理变化,又有化学变化
C该过程中瓶内物质总质量不断减少
D氧气浓度小于一定值时,蜡烛无法燃烧
【答案】酒精灯 长颈漏斗 2KClO3![]() 2KCl+3O2↑ 集气瓶口有气泡冒出(水槽中有气泡冒出) 水倒吸引起试管破裂 适中 丙 CaCO3+2HCl =CaCl2+H2O+CO2↑ BCDE Ca(OH)2+CO2 =CaCO3↓+H2O 装置内压强增大,使固液分离 便于气体导出 BD
2KCl+3O2↑ 集气瓶口有气泡冒出(水槽中有气泡冒出) 水倒吸引起试管破裂 适中 丙 CaCO3+2HCl =CaCl2+H2O+CO2↑ BCDE Ca(OH)2+CO2 =CaCO3↓+H2O 装置内压强增大,使固液分离 便于气体导出 BD
【解析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,二氧化碳和氢氧化钙生成碳酸钙和水。
①仪器的名称:a是酒精灯,b是长颈漏斗。
② 试管口没有塞棉花,用装置A制取氧气的反应是氯酸钾和二氧化锰加热生成氯化钾和氧气,反应的化学方程式为2KClO3![]() 2KCl+3O2↑,装置F是排水法收集氧气,判断氧气集满的方法是集气瓶口有气泡冒出(水槽中有气泡冒出);若在反应结束时未及时将导管移出水面熄灭酒精灯,可能发生的后果是水倒吸引起试管破裂。
2KCl+3O2↑,装置F是排水法收集氧气,判断氧气集满的方法是集气瓶口有气泡冒出(水槽中有气泡冒出);若在反应结束时未及时将导管移出水面熄灭酒精灯,可能发生的后果是水倒吸引起试管破裂。
③稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳。
试管编号 | 实验步骤 | 现象 | 结论 | |
甲 | 稀盐酸中放入粉末状碳酸钠 | 反应剧烈 | 产生大量气泡 | 选择丙为原料最合适,反应的化学方程式是 CaCO3+2HCl =CaCl2+H2O+CO2↑ |
乙 | 稀盐酸中放入粉末状碳酸钙 | |||
丙 | 稀盐酸中放入块状碳酸钙 | 反应适中 | ||
实验制取CO2用稀盐酸和碳酸钙不加热装置制取,故发生装置有BCDE。检验CO2气体常用澄清石灰水,反应为二氧化碳和氢氧化钙生成碳酸钙和水,反应的化学方程式是Ca(OH)2+CO2 =CaCO3↓+H2O。
④ 实验室用锌粒和稀硫酸可以在装置E中制取氢气,反应中关闭活塞K,反应就会自行停止的原因是装置内压强增大,使固液分离。
⑤ 装置A~E中导气管都只伸出橡皮塞一点点的原因是便于气体导出。
⑥A、蜡烛熄灭后瓶内剩余二氧化碳气体和水蒸气,故A不正确;
B、蜡烛熔化属于物理变化,生成二氧化碳和水蒸气属于化学变化,则实验过程中既有物理变化,又有化学变化,故B正确;
C、密闭的集气瓶,该过程中瓶内物质总质量不变,故C不正确;
D、氧气浓度小于一定值时,蜡烛无法燃烧,故D正确。故选BD。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
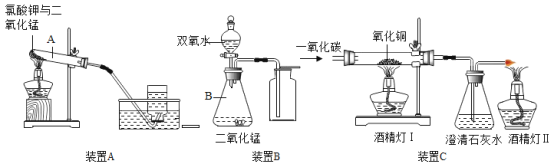
(问题讨论)用下图所示装置进行实验:
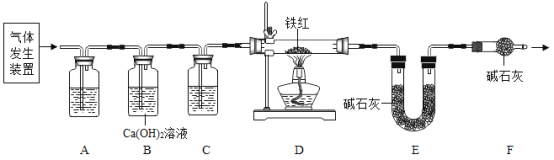
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)。
a 浓硫酸 b 澄清的石灰水 c 氢氧化钠溶液
(3)B装置的作用是________。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸。
②停止加热后_________。
(5)写出D装置中所发生反应的一个化学方程式____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(6)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。
(实验评价)
本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会____(填“偏小”、“不变”或“偏大”)。