题目内容
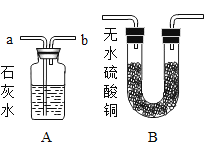
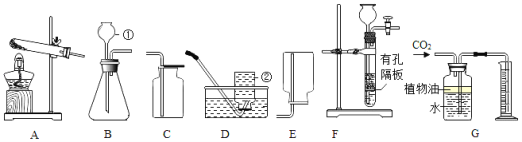
【题目】某同学利用下图所示的实验验证稀H2SO4与NaOH溶液能发生中和反应。
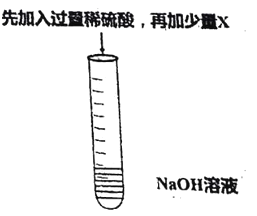
(1)NaOH溶液中存在的大量阳离子是______;
(2)加入稀硫酸后; .试管中发生化学反应的化学方程式______;
(3)为证明稀H2SO4和NaOH溶液能发生反应,x可以是下列物质中的_____。
A 酚酞
B CuSO4
C Na2CO3
D Ba(NO3)2
【答案】Na+ 2NaOH+H2SO4=Na2SO4+2H2O AB
【解析】
(1)氢氧化钠是由钠离子和氢氧根离子构成的化合物,NaOH溶液中存在的大量阳离子是钠离子。
(2)氢氧化钠与稀硫酸反应生成硫酸钠和水,发生化学反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O。
(3)向氢氧化钠溶液中加入过量的稀硫酸,得到的是硫酸钠和硫酸的混合溶液。
A、加入酚酞溶液不变红,说明氢氧化钠被反应完全,故正确;
B、硫酸铜能与氢氧化钠反应生成氢氧化铜沉淀,加入硫酸铜没有生成蓝色硫酸铜沉淀,说明氢氧化钠被反应完全,故正确;
C、硫酸是过量的,硫酸与碳酸钠反应生成二氧化碳气体,不管氢氧化钠和硫酸有没反应,都会有气体生成,故错误;
D、过量的硫酸和生成的硫酸钠都会与硝酸钡反应生成硫酸钡沉淀,不能证明氢氧化钠被反应了,故错误。
故答案为:
(1)钠离子;
(2)2NaOH+H2SO4═Na2SO4+2H2O;
(3)AB。

 走进文言文系列答案
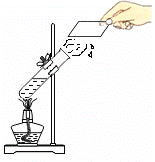
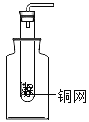
走进文言文系列答案【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图所示。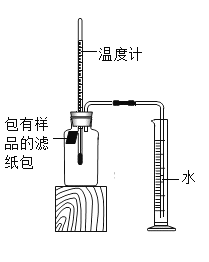
观察到量筒内水沿导管慢慢进入广口瓶(净容积为146ml,当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | 1g铁粉.0.2g碳,10滴水和少量NaCl | 100 | 70 | 约70 |
3 |
(1)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁绣蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_______(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是______。
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。______
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是______%(保留3位有效数字)。
【题目】水是生命之源,人类的日常生活与工农业生产都离不开水
|
|
|
A.水的沸腾 | B.水的电解 | C.水的净化 |
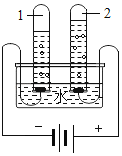
(1)①如图所示的3个实验,A中水发生了____(填“物理”或“化学”)变化;
②B中试管1内得到的气体的化学式为____,该实验证明了水由______________________
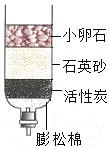
③C中活性炭的作用是____,经过此净水器得到的水仍然不是纯水,常用净化水的方法有:①过滤、②加明矾吸附沉降、③蒸馏、④消毒杀菌,要将混有泥沙的天然水净化为生活用的自来水.应选用的方法和顺序为_______
A.①②③④ B.②④①③ C.①③④ D.②①④
(2)检验一份自来水水样是硬水还是软水的方法是向水样中加入_________来鉴别,生活中常用______________的方法降低水的硬度。
(3)节约用水是每个公民的义务,下列用水方式应该提倡的是(填字母序号)________
A.用漱口杯接水刷牙
B.不间断地边流水边洗衣
C.用淘米水、洗菜水浇花、冲厕所
D.用喷灌、滴灌的方法浇灌农田和园林.