题目内容
【题目】兴趣小组的同学寒假期间参观故宫时对篆刻艺术产生了兴趣。他们查阅资料后尝试自行制作“化学印章”,并对印记效果进行了研究。

(查阅资料)篆刻中,印记白底红字称“朱文”,红底白字称“白文”。
实验1:初步实验。
用NaOH溶液浸泡白纸并晾干。用酚酞溶液作“化学印泥”。用不与酸碱反应的印章蘸取印泥,印在碱性白纸上产生的印记效果如下:
实验编号 | 1-1 | 1-2 | 1-3 |
NaOH溶液的浓度 | 4 g/L | 6 g/L | 20 g/L |
酚酞溶液的浓度 | 2 g/L | 6 g/L | 3 g/L |
印记颜色 | 浅红色 | 红色 | 红色 |
(1)酚酞“印泥”能在碱性白纸上留下红色印记,原因是__________。
(2)根据初步实验,可能影响印记颜色深浅的因素有__________。
实验2:深入探究。
取4 g/L NaOH溶液浸泡白纸并晾干,用不同浓度的酚酞做“化学印泥”继续实验。现象如下:
实验编号 | 2-1 | 2-2 | 2-3 |
NaOH溶液的浓度 | 4 g/L | 4 g/L | 4 g/L |
酚酞溶液的浓度 | 1g/L | 3 g/L | 5 g/L |
印记颜色 | 浅红色 | 浅红色 | 红色 |
(3)实验2的目的是_________。
(4)实验1和2中,支持猜想“NaOH溶液浓度会影响印记颜色”的实验是________ (填实验编号)。
(5)若所用印章文字是向外凸的,碱性纸上留下的印记效果是_______(填“朱文”或“白文”)。
(6)有同学希望印记产生“白文”效果,以下不能达到目的的做法是_________(填字母序号)。
A.用文字向外凸的印章,用 NaOH 溶液作“印泥”,白纸用酚酞溶液浸泡
B.用文字向外凸的印章,用稀盐酸做“印泥”,白纸用混有NaOH的酚酞溶液浸泡
C.用文字向内凹的印章,印泥和白纸同实验2中
【答案】酚酞溶液遇可溶性碱变红色 酚酞溶液的浓度、NaOH溶液的浓度 探究酚酞溶液的浓度对印记颜色的影响 1-3、2-2 朱文 A
【解析】
实验1:初步实验。
(1)可溶性碱能使无色酚酞溶液变红。因此酚酞“印泥”能在碱性白纸上留下红色印记的原因是:酚酞溶液遇可溶性碱变红色。
(2)根据实验1表格中的信息可知:NaOH溶液的浓度不同,印记显示的颜色不同;酚酞溶液的浓度不同,印记显示的颜色也不同。因此根据初步实验,可能影响印记颜色深浅的因素有:酚酞溶液的浓度和NaOH溶液的浓度。
实验2:深入探究。
(3)根据实验2表格中的信息可知:NaOH溶液的浓度相同时,酚酞溶液的浓度不同,印记显示的颜色不同。因此实验2的目的是:探究酚酞溶液的浓度对印记颜色的影响。
(4)根据对比实验的要求可知:实验1-3和实验2-2中酚酞溶液的浓度相同,NaOH溶液的浓度不同。因此支持猜想“NaOH溶液浓度会影响印记颜色”的实验是:1-3、2-2。
(5)根据印章的特点可知,若所用印章文字是向外凸的,碱性纸上留下的印记是红色的,效果是:朱文。
(6)A.用文字向外凸的印章,用NaOH溶液作“印泥”,白纸用酚酞溶液浸泡,NaOH溶液使酚酞变红,纸上留下的印记是红色的,效果是:朱文。该做法不能达到目的,符合题意;
B.白纸用混有NaOH的酚酞溶液浸泡,纸呈红色,用文字向外凸的印章,用稀盐酸做“印泥”,稀盐酸和氢氧化钠反应,接触部位红色变成无色,产生“白文”效果。该做法能达到目的,不符合题意;
C.该做法中印泥和白纸与实验2中相同,实验2中取NaOH溶液浸泡白纸并晾干,用酚酞做“化学印泥”,用文字向内凹的印章,盖上印章后,内凹的文字不与白纸接触,白纸不变色,而其他部位与白纸接触,酚酞溶液遇氢氧化钠变红,产生“白文”效果。该做法能达到目的,不符合题意。故不能达到目的的做法是A。

【题目】以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况剪。
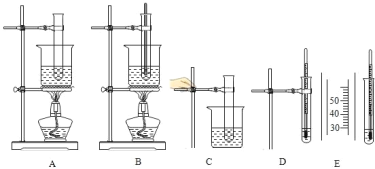
图A 是给试管中水和硝酸钾固体加热;
图B 是在加热过程中进行搅拌;
图 C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图 D是在溶液中插入温度计;
图 E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度.请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到 15.5g 时,小组同学分别测出的温度为74.9。C,75.0。C,75.3。C,他们将在实验报告中记录的温度是__.他们进行反复实验的目的是__
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格.请根据表格中已有数据,分析实验时,试管中盛有水的体积为__,并将表中空格内的相应溶解度填写完整.
试管中硝酸钾的总量/g | 5 | 6.5 | 8 | 10 | 12.5 |
开始析出晶体时的温度t/。C | 32.8 | 39.6 | 45.8 | 54.7 | 64.9 |
溶解度/g | 50 | _ | _ | _ | _ |
【题目】过氧化钠(Na2O2)可用作呼吸面具的供氧剂。实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究。
[查阅资料]过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2O2 +2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
[提出问题]过氧化钠是否变质?
[提出猜想]猜想一:________;
猜想二:过氧化钠部分变质;
猜想三:过氧化钠全部变质。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
①取部分固体于试管中,加入适量水,在试管口插入带火星木条 | 固体溶解,有气泡产生_______ | 猜想三不成立 |
②取少量①中溶液于另一试管中,滴加足量_______,振荡 | 有气泡生成 | 猜想二成立 |
[反思评价]
(1)请写出实验②中产生气泡的化学反应方程式_________;
(2)小华同学想通过实验,进一步确定部分变质的过氧化钠中是否含有氢氧化钠,于是进行了如下的实验操作:取少量①中溶液于试管中,加入足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中加入少量________,溶液变红,证明部分变质的过氧化钠中含有氢氧化钠。
(3)小明同学认为,小华同学的实验仍无法确定原固体样品中是否含有氢氧化钠,理由是________。
【题目】普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
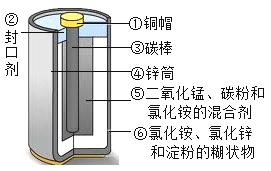
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 | 实验现象 | 结论或解释 |
①剥开干电池,取出碳棒周围的黑色粉末 | ||
②溶解、___(填操作名称)、洗涤 | 得到黑色粉末和无色澄清液体 | 黑色粉末的成分为__。 |
③对黑色粉末进行__ | 得到纯净的MnO2固体 | |
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ | _____ | 化学方程式为:______ |
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。