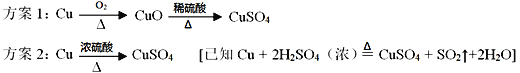题目内容
【题目】为了测定石灰石中碳酸钙的质量分数,某兴趣小组的同学称取石灰石样品12.5g,高温煅烧至质量不再改变,称得剩余固体质量为8.1g(假设杂质不参加反应)试计算:
(1)生成二氧化碳质量是____g。
(2)石灰石样品中碳酸钙的质量分数是多少_________?(写出计算过程)
【答案】 4.4g 80%
【解析】(1)据质量守恒定律可知反应前后物质的总质量不变,所以生成二氧化碳质量为:12.5g-8.1g =4.4g;
(2)解:设生成4.4g二氧化碳需要碳酸钙的质量为X
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
X 4.4g
![]() X==10g
X==10g
石灰石样品中碳酸钙的质量分数是10g÷12.5g×100%=80%
答、石灰石样品中碳酸钙的质量分数是80%

【题目】某些食品的包装袋内,放有装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。某同学对一袋久置空气中的干燥剂进行了探究。
他先取部分久置干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液。然后对滤液的酸碱性和白色固体的组成作了探究。
(实验探究一)探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显____________性。
(实验探究二)探究过滤后白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3。
他查阅有关资料得知:CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量。氢氧化钙微溶于水。
(分析判断)你认为该过滤后得到的白色固体中一定不含有的物质是_______。
(实验操作)下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告。
实验操作 | 实验现象 | 实验结论 |
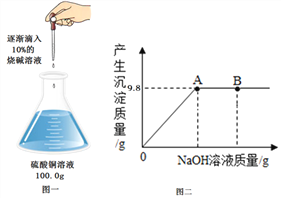
①取少量白色固体,倒入适量水,充分搅拌、静置; ②向上层清液中滴加无色酚酞溶液 | 上层清液呈____色 | 白色固体中一定含有氢氧化钙 |
另取少量白色固体放入试管中,滴加稀盐酸 | _________ | 白色固体中一定含有碳酸钙 |
(总结反思)
只通过以上实验,还不能证明这袋久置于空气中的干燥剂中是否含有CaO。请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:____。用化学方程式表示其中的反应_____。
(实验探究三)探究干燥剂样品中碳酸钙的质量分数
取上述干燥剂样品10g放入如图的装置中,充分反应后,测出了量筒中的水的体积为220mL,(此状况下二氧化碳的密度是2g/L),则此干燥剂中碳酸钙的质量分数为___________(通过计算填空)
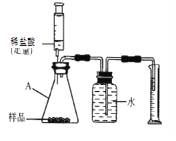
(总结反思)(实验探究三)中实验设计的不合理之处_________
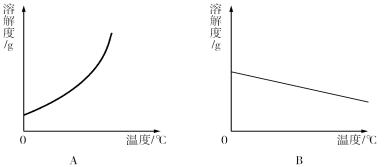
【题目】(6分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶度曲线的是 (填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。
其中措施正确的是 ;
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体的质量为 ;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量
乙 甲(填“>”、“<”或“=”);
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH固体,应采取的物理方法是 ;
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。