题目内容
【题目】某化学兴趣小组选择燃烧镁带进行定量实验研究
(资料)镁除了与空气中的氧气反应外,还可以与空气中的氮气在点燃条件下生成固体氮化镁Mg3N2,第一组同学称量了0.2g镁带,在空气中点燃,完全燃烧后,称量所得固体质量为0.30g。第二小组同学觉得第一小组的实验数据不合理,分析原因并设计了如下图所示的实验,实验步骤如下:
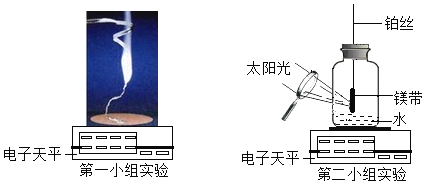
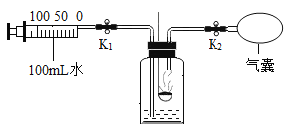
步骤一:将0.24g打磨光亮的镁带固定在穿过瓶塞的铂丝上(铂丝不反应),广口瓶盛满氧气并塞紧瓶塞(如图所示),瓶底留有适量的水;
步骤二:有聚光镜引燃镁带,待其完全燃烧后,充分震荡瓶内的水再静置,瓶内白烟完全消失,有白色固体沉淀在瓶底;(此条件下氧化镁难溶于水且不与水反应)
步骤三:将瓶内全部的固液混合物过滤,干燥滤纸及其表面的滤渣后一起称量,总质量为0.75g.(固体损失忽略不计)
请回答下列问题:
(1)写出镁带在空气中燃烧的化学方程式(只写一个)_______
(2)关于两个小组实验的说法正确的是_____
A 第一组实验数据不合理是因为0.3g>0.24g,不遵守质量定律
B 第二组实验中的水既可以加速装置冷却,又可以通过水帮助收集瓶内的生成物
C 镁带燃烧时有白烟飘散的现象说明分子是永不停歇的作无规则运动的
D 通过第一组实验数据可以推测,镁在空气中燃烧一定生成了氮化镁
E 第二小组同学只需称量镁带燃烧前后封闭的广口瓶体系的总质量,即可验证质量守恒定律定律
(3)第二小组同学在进行实验时,若未打磨去除镁带表面的氧化膜,最后他们称量的滤纸和滤渣总质量会____0.75g(填> < =)
(4)根据第二小组同学的实验数据,若要得到与氧气反应的质量,还必须测量___若实验结果与质量守恒向吻合,请推测以上测量值为_____
【答案】2Mg+O2![]() 2MgO BDE < 滤渣质量 0.4g
2MgO BDE < 滤渣质量 0.4g
【解析】
(1)镁带在空气中与氧气燃烧的化学方程式:2Mg+O2![]() 2MgO;与氮气反应堆的化学方程式:3Mg+N2
2MgO;与氮气反应堆的化学方程式:3Mg+N2![]() Mg3N2;
Mg3N2;
(2)A、第一组实验数据不合理是因为0.3g>0.24g,化学反应都遵守质量定律;故选项错误;
B、第二组实验中的水既可以加速装置冷却,氧化镁难溶于水且不与水反应,可以通过水帮助收集瓶内的生成物;
C、镁带燃烧时有白烟飘散的现象属于宏观现象,不能说明分子是永不停歇的作无规则运动的;故选项错误;
D、通过第一组实验0.20g镁燃烧产生0.30g固体物质,2Mg+O2![]() 2MgO ,0.20g镁在氧气中完全燃烧产生氧化镁的质量为:
2MgO ,0.20g镁在氧气中完全燃烧产生氧化镁的质量为:![]() =0.33g,大于0.30g,数据可以推测,镁在空气中燃烧一定生成了氮化镁;故选项正确;
=0.33g,大于0.30g,数据可以推测,镁在空气中燃烧一定生成了氮化镁;故选项正确;
E、第二小组同学只需称量镁带燃烧前后封闭的广口瓶体系的总质量,即可验证质量守恒定律定律;故选项正确;
故选:BDE;
(3)第二小组同学在进行实验时,若未打磨去除镁带表面的氧化膜,镁带不能充分和氧气反应,质量会减少,最后他们称量的滤纸和滤渣总质量会<0.75g;
(4)根据第二小组同学的实验数据,若要得到与氧气反应的质量,还必须测量氧化镁固体质量,若实验结果与质量守恒向吻合,0.24g打磨光亮的镁带与氧气完全反应产生氧化镁的质量为=![]() 。
。