题目内容
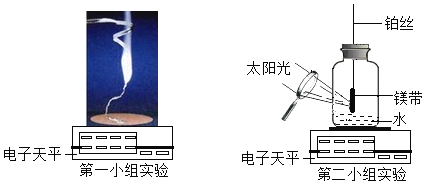
【题目】构成物质的粒子之间的关系如图所示。回答下列问题。
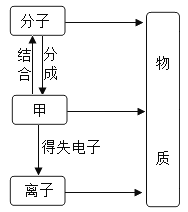
(1)甲是_____________。
(2)在水、汞和氯化钠三种物质中,由离子构成的物质是______;保持水化学性质的最小粒子是_________。
(3)氮气是由无数的___________构成的,一个氮分子是由____________构成的。
【答案】原子 氯化钠 水分子 氮分子 两个氮原子
【解析】
(1)据图可以看出,甲可以构成分子,可以形成离子,故甲是原子;
(2)在水、硫和氯化钠三种物质中,由离子构成的物质是氯化钠,氯化钠由钠离子和氯离子构成的;分子是保持物质化学性质的最小粒子,保持水化学性质的最小粒子是水分子。
(3)氮气是由无数的氮分子构成的,一个氮分子表示为![]() ,一个氮分子是由两个氮原子构成的。
,一个氮分子是由两个氮原子构成的。

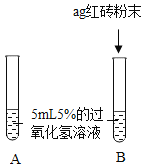
【题目】二氧化锰是不是过氧化氢溶液分解的唯一催化剂?对此小明设计了如下探究方案。
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释` |
I.
| A中无明显现象,B中产生大量能使带火星木条复燃的气体。 | ①产生的气体是_________。 ②红砖粉末能改变过氧化氢分解速率。 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液;反应停止后过滤、洗涤、干燥、称量滤渣。 | B又产生大量能使带火星木条复燃的气体;滤渣质量等于ag。 | 红砖粉末的_______、_______在反应前后均没有发生变化,能作过氧化氢分解的催化剂。 |
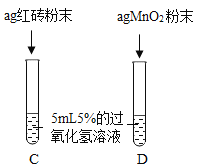
III.
| 两试管中均产生气泡且_______ 。 | 红砖粉末的催化效果没有二氧化锰粉末好。 |
请写出红砖粉末(成分以Fe2O3表示)催化过氧化氢溶液分解反应的化学方程式_______。
(反思)(1)小明在实验时发现试管内有许多水雾,由此推断过氧化氢分解是_______(填“放热”或“吸热”)反应。
(2)实验过程中发现将过氧化氢溶液加入红砖粉末的试管后,反应速率是逐渐加快,然后又逐渐变慢。从影响反应速率的因素来分析过氧化氢分解速率变化的原因________。