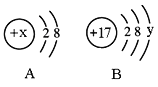题目内容
【题目】下图是两种元素在周期表中的信息。请回答:
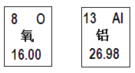
(1)氧元素的原子序数是________;氧离子的符号是________。
(2)若铝离子的结构示意图为:![]() ,则Y=________
,则Y=________
(3)写出这两种元素组成的化合物的化学式_____________。
【答案】 8 O2- 8 Al2O3
【解析】本题考查了周期表中的信息,粒子结构示意图及其意义,化学式的书写。了解粒子结构示意图的意义是正确解题的关键.
(1)左上角数字表示该元素的原子序数,氧元素的原子序数是8;氧原子最外层电子数为6,在化学反应中易得到2个电子形成稳定结构,带2个单位的负电荷,所以氧离子可表示为:O2-;
(2)根据铝元素在周期表中的信息,可知铝元素的原子序数为13,而原子序数等于其核内的质子数,因此铝元素的核内质子数为13,即X=13,根据铝离子是铝原子失去3个电子得到的,因此Y=13-2-3=8;
(3)在化合物中氧元素通常显-2价,由铝原子易失去3个电子也可知铝的常见化合价为+3价,故氧化铝的化学式为Al2O3。

【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线,请回答:
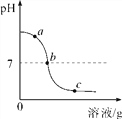
(1)由图可知该实验操作是将____________滴加到另一种溶液中;
(2)该反应的化学方程式为________________________________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了做标记,他设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3===CaCO3↓+2NaCl。
【探究过程】①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现____________________________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液 | ||
__________________ | 该样品为b处溶液 | |
先有____________产生,后有____________产生 | 该样品为c处溶液,并推知溶液中的阳离子有________________ |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑________________________________。
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的研究。
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M 溶液的溶质有两种可能:①是___________;②是CaCl2。
(2)【设计实验】同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加___________ | ____________________ | 猜想①正确 |
探究二:过滤后澄清滤液中会有哪些溶质?
(1)【提出猜想】猜想一:NaOH 和Na2CO3;猜想二:________________;猜想三:NaOH。
(2)【实验验证】同学们针对“猜想一”进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,滴加少量的稀盐酸 | 无气体产生 | 猜想一不成立 |
他们的实验结论是否正确?________,理由是____________________。
(3)【继续探究】设计实验方案确定滤液中溶质的组成。
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入____________溶液 | _________________ | 猜想二成立 |