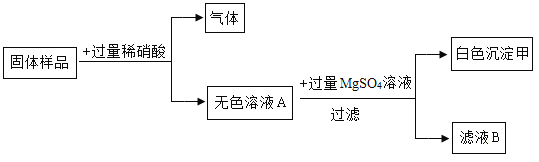
题目内容
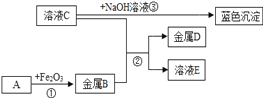
【题目】A~I是初中化学常见的物质,他们之间的相互关系如下图所示,(“→”指向生成物。)其中B是铁锈的主要成分,G是黄色溶液,A.C常温下是气体,H和I中含有一种相同元素,I是红褐色沉淀,H不溶于稀硝酸。请回答下面问题:

(1)物质I的化学式是_____,物质E的化学式是_____。
(2)反应②的化学方程式为_____,基本反应类型是_____。
(3)物质F属于_____(填“酸”、“碱”、“盐”或“氧化物”)。
(4)物质C呈固态时的俗名是_____,用途有_____(写一点即可);
(5)反应①的化学方程式为_____。
【答案】Fe(OH)3 H2SO4 ![]() 复分解反应 碱 干冰 灭火(或作气体肥料或化工产品的原料等合理答案)
复分解反应 碱 干冰 灭火(或作气体肥料或化工产品的原料等合理答案) 
【解析】
A~I是初中化学常见的物质,其中B是铁锈的主要成分,故B是氧化铁,G是黄色溶液,故G是可溶性铁盐,A、C常温下是气体,A、B高温会生成C、D,故A是一氧化碳,所以C是二氧化碳,D是铁,氧化铁和E会生成G,所以E是酸,H和I中含有一种相同元素,H不溶于稀硝酸,所以H是氯化银或硫酸钡,H和I中含有一种相同元素,所以含有的相同的元素是氧元素,则H是硫酸钡,I是红褐色沉淀,故I是氢氧化铁,E是硫酸,G是硫酸铁,硫酸铁和氢氧化钡反应生成硫酸钡和氢氧化铁,F是氢氧化钡,经过验证,推导正确。
由分析可知(1)I是Fe(OH)3,E是H2SO4;
(2)反应②氧化铁和稀硫酸反应生成硫酸铁和水,反应的化学方程式为![]() ,该反应属于复分解反应;
,该反应属于复分解反应;
(3)F是氢氧化钡,属于碱类物质;
(4)C是二氧化碳,其固体俗称干冰,可用于灭火、人工降雨等;
(5)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳的反应,化学方程式为: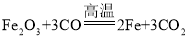 。
。

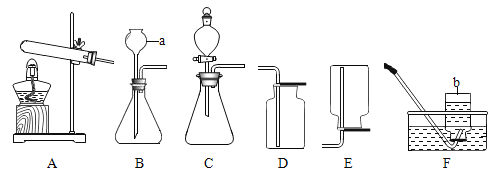
【题目】小晨同学从课外读物中得知:在加热条件下,钠与CO2反应的产物可能有C、CO、Na2CO3、Na2O。于是设计实验对产物成分进行探究。
(查阅资料)①BaCl2溶液呈中性;②4Na+O2=2Na2O;③Na2O+H2O=2NaOH;④2Na+2H2O=2NaOH+H2↑;⑤CO通入PdCl2溶液中有黑色沉淀生成。
(提出问题)在加热条件下,钠与CO2反应的产物有哪些?
(猜想假设)猜想一:产物中一定有C 猜想二:产物中一定有CO
猜想三:产物中一定有Na2CO3 猜想四:产物中一定有Na2O
(实验验证)用下图所示装置(夹持装置已略去)进行实验探究。
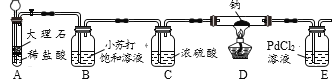
装置A中发生反应的化学方程式为_____;装置C的作用是_____。
序号 | 实验操作 | 实验现象 | 实验结论 |
(1) | 待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 | 有黑色不溶物 | 猜想____正确 |
(2) | 将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 | _____ | 猜想三正确 |
(3) | _____ | 猜想二正确 |
(反思与评价)小晨同学向实验(2)所得溶液中滴入几滴酚酞溶液,溶液呈红色。 于是得出结论:在加热条件下,钠与CO2反应一定产生Na2O。该结论是否严谨?____(填“是”或“否”),理由是____。