题目内容
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如下实验(如图),实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。
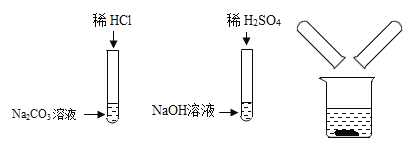
(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl、Na2CO3;
猜想3:Na2SO4、NaCl、H2SO4;
(实验探究)取烧杯中的溶液,进行如下实验:
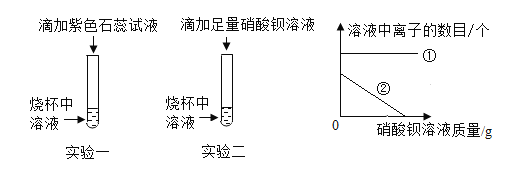
(收集证据)若猜想3成立,实验一的反应现象为_____,实验二发生反应的化学方程式为_____。
(实验结论)实验二不能完成实验任务的原因是_____,猜想3成立。
(表达交流)实验中滴加石蕊试液的作用是_____。在滴加硝酸钡溶液的过程中,如图中①表示的是_____(填符号),②表示的是_____(填符号)。
(总结规律)通过探究还可以认识到:(1)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑_____。
(2)两种化合物在溶液中都是以离子的形式存在,确定物质的成分可以从确定_____的角度来解决。
【答案】紫色石蕊试液变成红色。 ![]() ;
;![]() 硝酸钡与硫酸和硫酸钠、碳酸钠都能反应生成白色沉淀,而在实验过程中硫酸和氢氧化钠反应一定生成硫酸钠,加入硝酸钡后,一定能生成硫酸钡白色沉淀,所以无法证明硫酸(或碳酸钠)的有无,所以实验二不能完成实验任务。 通过石蕊试液颜色的改变,从而判断溶液的酸碱性,验证猜想的正确与否 Na+、Cl-、H+ SO42- 反应物过量问题 离子
硝酸钡与硫酸和硫酸钠、碳酸钠都能反应生成白色沉淀,而在实验过程中硫酸和氢氧化钠反应一定生成硫酸钠,加入硝酸钡后,一定能生成硫酸钡白色沉淀,所以无法证明硫酸(或碳酸钠)的有无,所以实验二不能完成实验任务。 通过石蕊试液颜色的改变,从而判断溶液的酸碱性,验证猜想的正确与否 Na+、Cl-、H+ SO42- 反应物过量问题 离子
【解析】
[收集证据]
若猜想3成立,则溶质为Na2SO4、NaCl、H2SO4,实验一滴加紫色石蕊,试液变红色。实验二滴加硝酸钡溶液,硫酸钠和硝酸钡生成硫酸钡沉淀和硝酸钠,硫酸和硝酸钡生成硫酸钡沉淀和硝酸,化学方程式分别![]() ;
;![]() ,故填:紫色石蕊试液变成红色;
,故填:紫色石蕊试液变成红色;![]()
![]() 。
。
[实验结论]
硝酸钡与硫酸和硫酸钠、碳酸钠都能反应生成硫酸钡白色沉淀,而在实验过程中硫酸和氢氧化钠反应一定生成硫酸钠,加入硝酸钡后,一定能生成硫酸钡白色沉淀,所以无法证明硫酸(或碳酸钠)的有无,所以实验二不能完成实验任务。
[表达与交流]
石蕊遇酸变红,实验中滴加石蕊试液的作用是通过石蕊试液颜色的改变,从而判断溶液的酸碱性,验证猜想的正确与否。在滴加硝酸钡溶液的过程中,硫酸根离子和钡离子生成沉淀, Na+、Cl-、H+离子数目没变,①表示的是Na+、Cl-、H+;SO42-数目逐渐减少,②表示的是SO42-,故填:通过石蕊试液颜色的改变,从而判断溶液的酸碱性,验证猜想的正确与否; Na+、Cl-、H+;SO42-。
[总结规律]
通过探究还可以认识到:
(1)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑可溶性的反应物是否有剩余。
(2)两种化合物在溶液中都是以离子的形式存在,确定物质的成分可以从确定离子的角度来解决,然后根据离子的种类判断物质的成分。
故填:反应物过量问题 ;离子。

 阅读快车系列答案
阅读快车系列答案【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
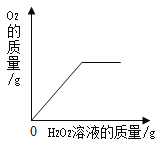
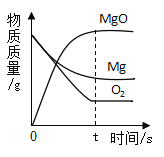
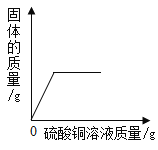
A.向一定质量的二氧化 锰中加入过氧化氢溶液 | B. 向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸 | C. 镁在氧气中燃烧 | D. 向一定量铁粉和铜粉混 合物中加入硫酸铜溶液 |
A.AB.BC.CD.D