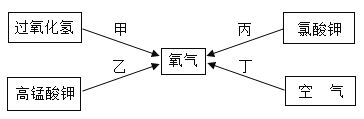
题目内容
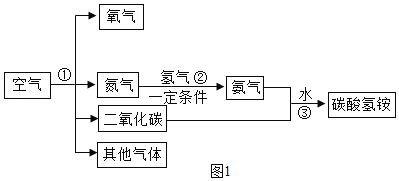
【题目】城市居民生活所需净水,主要靠自来水厂供给。自来水的生产过程如图所示。

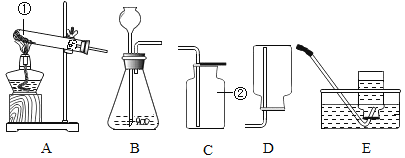
(1)下列属于自来水生产使用的净水方法是________(填序号)。
A沉淀 B过滤 C煮沸 D蒸馏
(2)自来水生产可用氯气进行杀菌消毒.请将氮气与水反应的化学方程式补充完整:![]() ________。
________。
(3)生活中检验软水、硬水可以用________,用________的方法降低水的硬度。
(4)保护水环境,节约用水是每个公民应尽的责任和义务.你认为下列做法与之不相符的是________。
A使用无磷洗涤剂
B关闭建在河边或湖边的所有化工厂
C向农民宣传科学知识,让他们禁止使用农药、化肥
D生活污水放入池塘里静置后再排入江河中
E洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所
【答案】AB ![]() 肥皂水 煮沸 CD
肥皂水 煮沸 CD
【解析】
(1)下列属于自来水生产使用的净水方法是:C煮沸 、D蒸馏;
(2)自来水生产可用氯气进行杀菌消毒.请将氮气与水反应的化学方程式补充完整: Cl2+H2O=HClO+HCl。
(3)生活中检验软水、硬水可以用肥皂水,用加热、煮沸的方法降低水的硬度。
(4)A、使用无磷洗涤剂,防止水体污染,符合保护环境;
B、关闭建在河边或湖边的所有化工厂;防止水体污染,符合保护环境;
C、向农民宣传科学知识,让他们合理使用农药、化肥;不符合保护环境;
D、生活污水进过处理后达到排放标准后再排入江河中;不符合保护环境;
E、洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所;符合保护环境;
故选:CD。

【题目】某兴趣小组同学探究影响双氧水分解速度的因素和验证质量守恒定律实验,数据记录如下:
双氧水的质量 | 双氧水的浓度 | 催化剂及质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | MnO2 0.1g | 9 mL |
Ⅱ | 50.0g | 2% | CuO 0.1g | 12 mL |
Ⅲ | 50.0g | 2% | MnO2 0.1g | 16 mL |
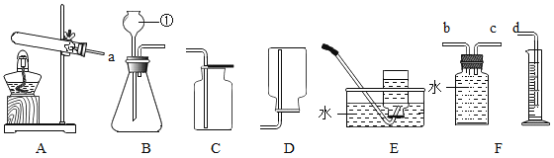
(1)本实验中,小李同学测量O2的体积可选择甲图中的___________(填编号)装置。
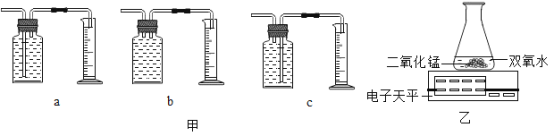
(2)通过实验_________(从“Ⅰ”“Ⅱ”“Ⅲ”中选填),小李得出结论:双氧水的浓度越大,分解速度越快;你认为根据实验记录的数据该小组同学还能得到______结论。
(3)小王同学用乙图装置进行实验,反应的化学方程式为_______;该反应属于________(填基本反应类型)。他通过比较_______,也得出了“双氧水浓度越大反应速度越快”的实验结论。
(4)小张同学看到电子天平数据比混合之前数据减小了,他认为该反应不遵守质量守恒定律。你认为他的看法_______(填正确或错误),原因是__________。
【题目】如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是
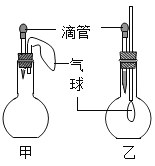
甲 | 乙 | |
A | 稀硫酸和铜片 | 水和 CO2 |
B | 双氧水和MnO2 | NaOH溶液和CO2 |
C | Na2CO3溶液和稀硫酸 | NaOH溶液和SO2 |
D | H2O和NH3 | 硝酸银溶液和HCl |
A.AB.BC.CD.D
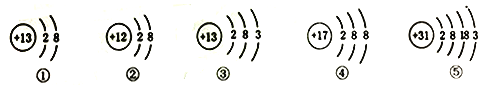
【题目】请回答:如图是元素周期表中的一部分,请回答下列问题.
第一周期 |
|
| ||||||
第二周期 |
|
|
| ① |
|
|
|
|
第三周期 |
|
|
|
|
|
| ② |
|
(1)表中,①所示元素的名称是_______,②所示元素组成的单质的化学式_______;
(2)![]() 与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.
与Ne的核外电子排布相同,则X的元素符号为_______,它处在元素周期表中第_______周期,它与氧元素组成的化合物的化学式为_______.