题目内容
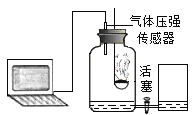
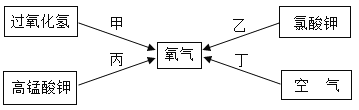
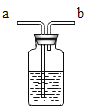
【题目】如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是
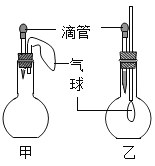
甲 | 乙 | |
A | 稀硫酸和铜片 | 水和 CO2 |
B | 双氧水和MnO2 | NaOH溶液和CO2 |
C | Na2CO3溶液和稀硫酸 | NaOH溶液和SO2 |
D | H2O和NH3 | 硝酸银溶液和HCl |
A.AB.BC.CD.D
【答案】BC
【解析】
A、甲中稀硫酸和铜片不反应,所以容器内气体压强不变,气球不变化;乙中二氧化碳部分溶于水,使容器内的压强小于大气压,所以气球变大,故错误;
B、甲中双氧水在二氧化锰的催化下迅速反应生成氧气,使容器内压强大于大气压,所以气球变大;乙中二氧化碳极易溶于氢氧化钠溶液,导致容器内的压强小于大气压,所以气球变大,故正确;
C、甲中稀硫酸和碳酸钠反应生成二氧化碳,导致容器内压强大于大气压,所以气球变大;乙中二氧化硫极易溶于氢氧化钠溶液,导致容器内的压强小于大气压,所以气球变大,故正确;
D、甲中氨气极易溶于水,导致容器内压强小于大气压,所以气球不会胀大;乙中硝酸银和HCl反应生成白色沉淀,导致容器内压强小于大气压,所以气球变大,故错误。
故选BC。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:
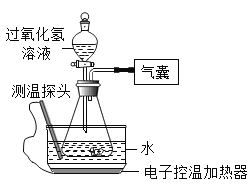
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.5g NaCl | 0.5g FeCl3 | ||||
60分内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定__________来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是__________(填序号)。
(4)通过实验①、②、④可得出的结论是_______________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是____________、____________(答两点)。
(6)你认为影响过氧化氢溶液分解速率的因素还有哪些?请设计实验验证你的猜想
(猜想假设)___________________。
(实验操作)___________________。
(实验结论)___________________。