题目内容
【题目】关于20%的硝酸钾溶液的含义,理解正确的是( )
A.100g该溶液中溶解了20g硝酸钾
B.将30g硝酸钾溶解到170g水中
C.将硝酸钾和水按照15:100的质量比配成溶液
D.将100g硝酸钾溶液,倒出一半,剩余溶液的溶质质量分数为10%
【答案】A
【解析】
溶质的质量分数是指溶质质量与溶液质量之比,其含义是指100份质量的某溶液中含多少份质量的该溶质。
A. 20%的硝酸钾溶液的含义可以理解为:100g硝酸钾溶液中含有20g硝酸钾,溶质质量分数为![]() ,说法正确;
,说法正确;
B. 将30g硝酸钾溶解到170g水中,所得溶液的溶质质量分数为![]() ,说法错误;
,说法错误;
C. 将硝酸钾和水按照15:100的质量比配成溶液,设非零比例常数a,则所得溶液的溶质质量分数为![]() ,说法错误;
,说法错误;
D. 溶液具有均一性、稳定性,将100g硝酸钾溶液,倒出一半,剩余溶液的溶质质量分数也为20%,说法错误。
故选:A。

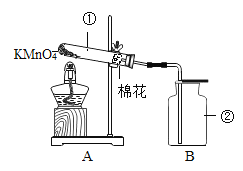
【题目】某小组同学研究“影响H2O2生成O2快慢的因素”的课题。
提出猜想:催化剂和反应物浓度都会影响H2O2生成O2的快慢。
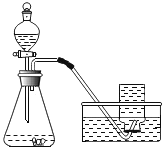
实验过程:按图连接好装置,并检查装置气密性良好,
将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录(见表)
实验编号 | ① | ② | ③ |
反应物 | 6%H2O2100ml | 6%H2O2 | 4%H2O2100ml |
加入固体 | 0.6g氯化钠 | 0.6g二氧化锰 | |
收集气体的时间 | 155s | 41s | 75s |
(1)实验②中加入H2O2的体积为_____ml
(2)实验③中加入的固体和用量为_____。
实验结论:
(3)当外界条件一样时,反应物浓度越_____(填“浓”或“稀”),H2O2生成氧气速率越快:在H2O2生成氧气过程中,二氧化锰催化作用比氯化钠_____(填“强”或“弱”)。
反思:
(4)为了更好地证明二氧化锰和氯化钠是否对H2O2生成氧气快慢有影响,还应该增加一组对比实验,该实验选用的药品和用量为_____。
拓展:
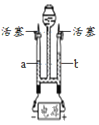
(5)进一步探究“MnO2的质量对H2O2分解反应的影响”,小组同学利用下图的装置进行实验,实验中用3%H2O2的溶液8ml与不同质量的MnO2混合,装置中产生氧气的量可以用压强传感器测出,(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计。)测得数据如图:
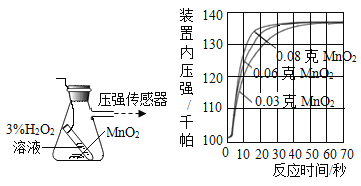
从图中可知,3%H2O2溶液8毫升与不同质量的MnO2混合时,其他条件相同的情况下,MnO2的质量越大,产生的氧气速率越_____。当MnO2的质最为0.08克时,产生氧气的速率刚好达到实验要求:在此实验条件下,现有2克MnO2,当它分解_____毫升3%H2O2溶液,其分解速率最接近实验要求。