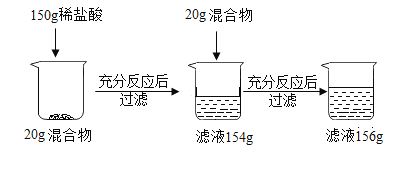
题目内容
【题目】现有A、B、C、D四种没有标签的无色溶液,分别是稀盐酸、碳酸钠溶液、澄清石灰水、氢氧化钠溶液中的一种,为了鉴别它们进行以下实验,实验步骤及现象如下:
(1)先分别取少量的四种溶液样品于洁净的试管中,再分别向四种溶液中滴加适量紫色石蕊溶液,结果A溶液显红色,B、C、D溶液显蓝色;
(2)B、C溶液混合后有白色沉淀产生,根据现象回答下列问题:B和C溶液混合发生反应的化学方程式为_____。
(3)物质鉴别完成后,取稀盐酸和氢氧化钠溶液进行实验,如图所示。
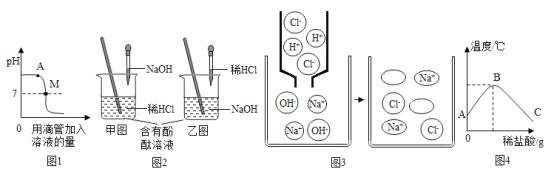
请回答以下有关中和反应的问题:
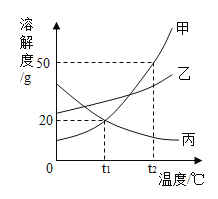
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2_____(填“甲”或“乙”)图所示进行的,曲线上A点溶质为_____(填化学式)。
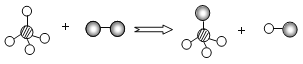
②图3是NaOH溶液与稀盐酸恰好完全反应的微观示意图,若反应后溶液pH为7,图3中微粒的化学式为_____。反应前后各元素的化合价_____(填“改变”或“没有改变”)。
③根据乙图进行的实验中,用温度计测出烧杯中溶液的温度变化如图4所示:由图知,稀盐酸与氢氧化钠溶液发生的反应是_____(填“放热”或“吸热”)反应。
(4)下列物质不能用来鉴别稀盐酸和氢氧化钠溶液的是_____。
A 硫酸铜溶液 B pH试纸 C 氯化钠溶液 D 大理石
【答案】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 乙 NaCl、NaOH H2O 没有改变 放热 C
【解析】
(2)石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,稀盐酸、碳酸钠溶液、澄清的石灰水、氢氧化钠溶液分别显酸性、碱性、碱性、碱性,取四种溶液分别滴加石蕊试剂,能使石蕊溶液变红色的是稀盐酸,其余为蓝色,故A为稀盐酸;B、C溶液混合后有白色沉淀产生,其中碳酸钠和氢氧化钙反应产生碳酸钙沉淀和氢氧化钠,反应的方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,因此剩下的D是氢氧化钠。
(3)氢氧化钠溶液呈碱性,盐酸溶液呈酸性,由图一可知溶液由碱性变为了酸性,故应该是碱中加酸,A点pH大于7说明反应过程中,氢氧化钠有剩余,故此时溶质为氯化钠和氢氧化钠;氢氧化钠可以和稀盐酸反应生成氯化钠和水,反应方程式为:HCl+NaOH=NaCl+H2O。而氯化钠在溶液中以钠离子和氯离子的形式存在,结合图中信息可以知道微粒为水;
(4)因为氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀;pH试纸可以鉴别稀盐酸和氢氧化钠溶液;稀盐酸与大理石反应生成气体;故不能用来鉴别稀盐酸和氢氧化钠溶液的是氯化钠溶液。故选C。
故答案为:
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;(3)①乙;NaCl、NaOH;②H2O; 没有改变;③放热;(4)C。