题目内容
【题目】如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
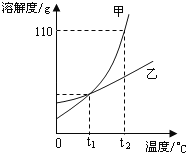
A.t1℃时,甲、乙两种物质的饱和溶液中溶质质量一定相等
B.t2℃时,甲的溶解度大于乙的溶解度
C.甲中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时,向60g甲固体中加入50g水,充分搅拌后能得到105g溶液
【答案】A
【解析】
试题分析:A、t1℃时,甲和乙的溶解度相等,甲、乙两种物质的饱和溶液中溶质质量分数相等,但是没说明溶液质量,不能判断含溶质是否相等,故A说法错误;
B、从t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小是甲>乙,故B说法正确;
C、如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于甲的溶解度受温度影响较大,所以用冷却热饱和溶液的方法提纯甲,故C说法正确;
D、t2℃甲物质的溶解度是110g,即在t2℃100g水中最多溶解110g甲物质,所以50g水中最多溶解55g甲物质,所得溶液质量为:55g+50g=105g,故D说法正确.
故选A.

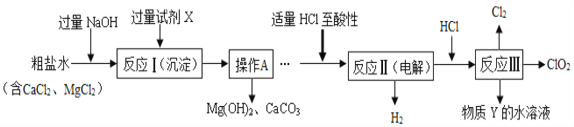
【题目】某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:
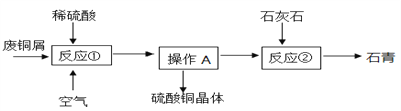
【产品制备】
(1)反应①在80℃条件下制备硫酸铜,其化学方程式为________,该化工厂后期发现,可用纯氧代替空气,既能加快反应速率又能________。
(2)硫酸铜晶体(CuSO45H2O)的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
操作A具体过程是:除杂,______、降温到30℃结晶、过滤、冰水洗涤、低温烘干。过滤时玻璃棒的作用是_____,剩余硫酸铜溶液的溶质质量分数为______,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是______。
(3)车间将CuSO4·5H2O、生石灰分别与水按1:50的质量比混合,然后把得到的两种液体在木桶里来配制波尔多液,该过程发生的化合反应的方程式为_________。
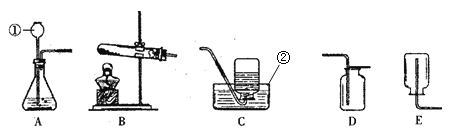
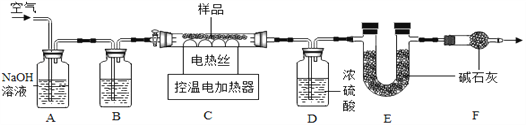
【组成测定为测定其组成】小组同学称取石青样品,用如图装置进行实验。
查阅资料:①石青的化学式可表示为aCuCO3b Cu(OH)2;②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
实验步骤:①连接仪器, ,准确称取34.6g aCuCO3bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞, ;⑤冷却后,称量,装置D增重1.8g,装置E增重8.8g。
(4)完善实验步骤中的填空:①________;④__________。
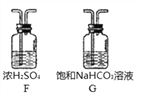
(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______(填名称)。
(6)通过计算可得:a:b=__________。(写出实验过程2分)
(7)若缺少F装置,测得的a:b________(选填“偏大”、“偏小”、“不变”)。
【脱水探究】
硫酸铜晶体受热会逐步失去结晶水。取纯净CuSO45H2O固体2.50g,放在上图实验装置C中进行加热,测定固质量随温度的变化情况如图所示。
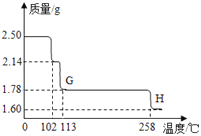
(8)G点固体的化学式是_________。
(9)G→H看到的现象是_________。
(10)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。