题目内容
【题目】取硫酸镁和氯化镁的混合物15 g,加入120 g水使其完全溶解,再加入100 g氯化钡溶液恰好完全反应,过滤,得211.7 g滤液(不考虑实验过程中质量的损失)。请计算:
(1)该混合物中硫酸镁的质量为多少?
(2)反应后所得滤液中溶质的质量分数为多少?(计算结果精确到0.1%)
【答案】(1)12g(2)5.9%
【解析】
解:硫酸钡的质量:120g+15g+100g-211.7g=23.3 g
设样品中硫酸镁的质量为x,生成氯化镁的质量为y
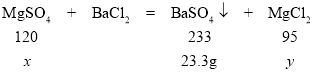
120:233 = x:23.3 g x =12 g
233:95 =23.3 g:y y= 9.5 g
原样品中氯化镁的质量=15 g – 12 g = 3 g
反应后溶液中溶质的质量分数=![]() ×100% ≈ 5.9%
×100% ≈ 5.9%
答:(1)该混合物中硫酸镁的质量为5.9%;
(2)反应后所得滤液中溶质的质量分数为5.9%。

【题目】实验室里现有氯酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸,以及下列仪器,请回答有关问题。
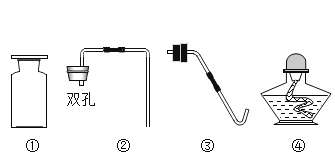
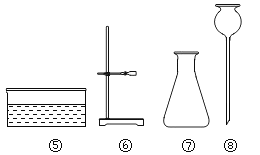
(1)利用上述仪器和试剂可以制取二氧化碳,你选择的仪器是__________ (填序号),可用向上排空气法收集二氧化碳的原因是__________。
(2)若补充一种仪器,再利用上述仪器和试剂还可以制取氧气,反应的化学方程式为____。
(3)同学查阅资料得知,鸡蛋壳的主要成分是碳酸钙,请设计实验证明鸡蛋壳中含有碳酸根离子,并完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
_______________ | _______________ | 鸡蛋壳中含有碳酸根离子 |
【题目】化学实验小组的同学在实验室里发现桌上有瓶敞口放置已久的NaOH溶液,他们对溶质的成分产生了探究的欲望。
[提出问题]这瓶NaOH溶液一定变质了,其变质程度如何呢?
[提出猜想]猜想一:NaOH溶液部分变质
猜想二:NaOH溶液完全变质
[实验探究]
(1)氢氧化钠溶液变质的原因为_____(用化学方程式表示)。
(2)小组的同学设计了如下实验进行探究,请根据表中内容填写:
实验步骤 | 现象 | 结论 | |
步骤一 | 取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl2溶液 | 产生白色沉淀 | 猜想__成立 |
步骤二 | 过滤,向滤液中滴加酚酞试液 | 溶液变红色 | |
上述步骤一中,滴加过量CaCl2溶液的目的是____;步骤二中根据酚酞试液变红这一现象证明样品中含有___(填字母)。
A CaCl2
B Na2CO3
C NaOH
D Na2CO3和NaOH
[实验反思]
(1)下列物质中①BaCl2溶液、②Ca( NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代步骤一中CaCl2溶液的是____(填序号)。
(2)步骤二中用另外一种试剂代替酚酞试液也能得出同样的结论,发生反应的化学方程式为________。
(3)通过探究,实验室中的氢氧化钠应密封保存。