题目内容
【题目】金属在生产和生活中有着广泛应用,回答下列与金属有关的问题。
(1)下列金属制品在应用中,利用金属导热性的是_____。
a.金属硬币 b.铜制火锅 c.铝制导线
(2)铝比铁活泼,但铝在空气中比铁稳定,其原因是_____。
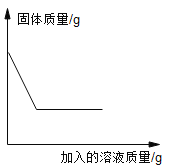
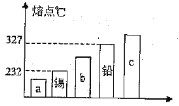
(3)合金是重要的金属材料。如图中能表示锡铅合金的是_____(选填“a”“b”或“c”)。
(4)镁铝合金被誉为“21世纪绿色金属结构材料”。镁,铝按其一定比例熔合后冷却可得到一种储氢合金材料Mg17Al12,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为_____。
(5)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。写出磁铁矿的主要成分与一氧化碳反应的化学方程式_____。
(6)某炼铁厂要冶炼1000t含杂质3%的生铁,需要含Fe2O380%赤铁矿石的质量是_____t(计算结果小数点后面保留一位)。
【答案】b 铝和空气中的氧气反应生成致密的氧化铝薄膜,阻碍铝的进一步反应 a Mg17All2+17H2=17MgH2+12Al 4CO+Fe3O4 3Fe+4CO2 1732.1
3Fe+4CO2 1732.1
【解析】
(1)日常生活中,金属的导热性用来制造炊具;
故选:b。
(2)铝比铁活泼,但铝在空气中比铁稳定,是因为铝与空气中的氧气反应生成致密的氧化铝薄膜,阻碍铝的进一步氧化,所以铝在空气中比铁稳定;
故填:铝和空气中的氧气反应生成致密的氧化铝薄膜,阻碍铝的进一步反应。
(3)合金是重要的金属材料。合金的熔点比组成它的金属的熔点低,故图中能表示锡铅合金的是a;
故填:a。
(4)储氢合金材料Mg17Al12,完全吸收氢气后得到MgH2和Al,实际就是Mg17Al12与氢气反应生成MgH2和Al,反应的化学方程式是![]() ;
;
故填:![]() 。
。
(5)磁铁矿的主要成分是四氧化三铁,它与一氧化碳反应生成铁和二氧化碳,反应的化学方程式是
故填: 。
。
(6)根据生铁中铁的质量,计算出所需氧化铁的质量,最后再计算出赤铁矿石的质量;
解:①1000t含杂质3%的生铁中铁的质量=1000t×(1-3%)=970t;
②设生成970t铁需要氧化铁的质量是x

![]()
X=1385.7t
③需要含Fe2O380%赤铁矿石的质量=1385.7t÷80%=1732.1t
故填:1732.1t。