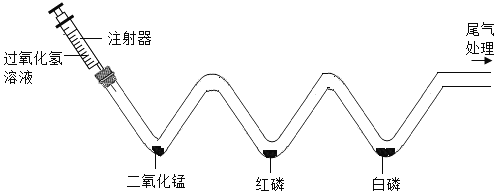
题目内容
【题目】向一定质量的固体中加入某溶液,反应后固体质量的变化图与下图相符的是
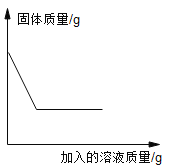
A.MnO2粉末中加入H2O2溶液
B.Cu—Zn合金中加入稀盐酸
C.CaCO3粉末中加入过量盐酸
D.Fe丝中加入CuSO4溶液
【答案】B
【解析】
A、MnO2粉末中加入H2O2溶液,MnO2是H2O2反应的催化剂,反应前后化学性质和质量保持不变,随着H2O2溶液的加入,固体的质量保持不变,A选项固体质量与加入溶液质量的关系变化不正确,不符合题意;
B、Cu—Zn合金中加入稀盐酸,锌与稀盐酸反应,铜与稀盐酸不反应,随着稀盐酸的加入,固体的质量逐渐减小,锌完全反应后,继续加入稀盐酸,固体的质量不再变化,B选项固体质量与加入溶液质量的关系变化正确,符合题意;
C、CaCO3粉末中加入过量盐酸,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应后无固体物质,随着稀盐酸的加入,固体的质量逐渐减小一直到0,C选项固体质量与加入溶液质量的关系变化不正确,不符合题意;
D、Fe丝中加入CuSO4溶液,铁与硫酸铜反应生成铜和硫酸亚铁,每56份质量的铁置换出64份质量的铜,固体质量会增加,D选项固体质量与加入溶液质量的关系变化不正确,不符合题意。故选B。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案【题目】阅读下面科普短文。
苹果富含多种微量元素和维生素等人体所需的营养成分,有健脾开胃、补心益气的作用。常吃苹果还可以帮助降低胆固醇,提高免疫力。
表1 某苹果的主要营养成分(每100 g)
营养成分 | 糖类/g | 脂肪/g | 蛋白质/g | 维生素A/mg | 维生素C/mg | 钾/g | 钙/g | 铁/mg |
含量 | 16.21 | 0.17 | 0.26 | 3 | 4 | 0.12 | 0.04 | 0.6 |
食用苹果时,应避免食用果核部分。因苹果籽中含有氰苷,氰苷在人体中易转化为剧毒物质氢氰酸(HCN)。苹果加工时容易褐变,影响外观、风味,还会造成营养流失。褐变主要是由于苹果中的酚类化合物在多酚氧化酶的催化下被氧化,因此,对于苹果中多酚氧化酶的特性研究就显得尤为重要(温度对富士苹果中多酚氧化酶相对活性的影响见图)。研究发现柠檬酸能较好地抑制苹果中多酚氧化酶的相对活性。
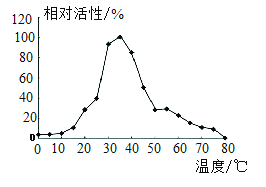
依据文章内容,回答下列问题:
(1)苹果在加工中发生的褐变属于_____变化(填“物理”或“化学”)。
(2)在日常食用苹果时应避免食用果核,因为苹果籽中的氰苷在人体内易转化为剧毒物质_____。
(3)由图1可知,多酚氧化酶的相对活性与温度的关系是_____。
(4)加工苹果时,加入_____可以抑制苹果的褐变。
(5)下列说法中,正确的是_____(填序号)。
A 苹果营养丰富,适量食用有益健康
B 高胆固醇人群不宜食用苹果
C 表1中的钾指的是钾元素
D 苹果中维生素C的含量高于蛋白质
【题目】化学课上同学们进行实验验证酸的性质。
I. 与指示剂作用。

(1)在白色点滴板孔穴1、3中加入紫色石蕊溶液,观察到溶液变_____色。
(2)将无色酚酞溶液滴加到孔穴2、4中,观察到孔穴4中溶液为无色,而孔穴2中溶液变为橙色。同学们猜想孔穴2中的异常现象与硫酸溶液的浓度过高有关,并通过以下实验证明该猜想正确:取少量上述橙色溶液于试管中,加水稀释,观察到的现象是_____。
II. 与铁锈反应。
实验 | 实验试剂 | 实验现象 |
1 | 锈蚀铁钉+10 mL 稀盐酸 | 生成无色气泡,铁锈较快消失,溶液颜色变黄。 |
2 | 锈蚀铁钉+10 mL 稀硫酸 | 生成无色气泡,铁锈减少速度缓慢,溶液颜色未变黄。 |
(提出问题)实验1、2现象不同的原因是什么?
(查阅资料)HCl在水中会解离出H+和Cl-,H2SO4在水中会解离出H+和SO42-。
(假设猜想)可能和溶液中阴离子不同有关。
(进行实验)
实验 | 实验试剂 | 实验现象 |
3 | 锈蚀铁钉+10 mL稀硫酸 + _A_ | 生成无色气泡,铁锈减少速度比实验2快,溶液颜色变黄。 |
4 | 锈蚀铁钉+10 mL稀盐酸 + Na2SO4 | 生成无色气泡,铁锈减少速度比实验1慢,溶液颜色变黄。 |
(解释和结论)
(3)铁锈(主要成分为Fe2O3)和盐酸反应的化学方程式是_____。
(4)实验1中产生的无色气体是_____。
(5)实验3中,物质A是_____。
(6)结合实验1~4,得出的结论是_____。