题目内容
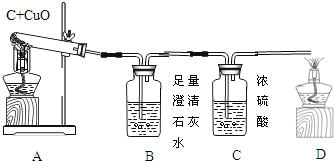
【题目】如图A为碳还原氧化铜的实验装置图。老师指出反应物不同的质量比可能会影响生成物的种类,在学习时,可以从定性观察和定量分析两个角度来判断生成物。请你跟随老师的思路,探究碳还原氧化铜生成的气体.(浓硫酸具有吸水性)
【提出问题】:碳还原氧化铜生成的气体是什么?
【作出猜想】:猜想①:CO 猜想②:CO2猜想③:__________
【实验设计】:装置图如图:
方案一:从定性观察角度判断:
(1)若猜想3成立
Ⅰ、B处的现象是___________________
Ⅱ、D处发生反应的化学反应方程式___________________________
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
Ⅰ、若猜想②成立,则m4m3___m1m2(选填“>”、“<”或“=”),此时A中的现象是__________________,B发生反应的化学方程式为 _________________________
Ⅱ、实际测量中B增加的质量小于理论值,请你分析可能的原因__________________________
【答案】 CO和CO2 澄清石灰水变浑浊 2CO+O2![]() 2CO2 = 黑色粉末变红色
2CO2 = 黑色粉末变红色 ![]() 装置内会残留少量的CO2未被澄清石灰水吸收
装置内会残留少量的CO2未被澄清石灰水吸收
【解析】本题考查了碳与氧化铜在高温条件下反应产物成分的探究,解题时根据题中提供的猜想中物质性质进行分析,在实验数据处理时根据质量守恒定律进行分析。
【作出猜想】:猜想③:CO和CO2;
方案一:从定性观察角度判断:
(1)若猜想③成立,应有二氧化碳和一氧化碳生成;
Ⅰ、二氧化碳能使澄清的石灰水变浑浊,一氧化碳能燃烧,则B处澄清的石灰水变浑浊;
Ⅱ、一氧化碳燃烧时生成了二氧化碳,化学方程式为:2CO+O2点燃2CO2;
方案二:从定量计算角度判断:
Ⅰ、若猜想②成立,则反应生成的二氧化碳被B中的澄清石灰水吸收,生成的二氧化碳来自固体减少的质量,故m4﹣m3=m1﹣m2,A中碳和氧化铜高温反应生成铜和二氧化碳,此时A中的现象是黑色粉末变红色,B发生反应是二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为![]() ;
;
Ⅱ、实际测量中B增加的质量小于理论值,可能的原因是:装置内会残留少量的CO2未被澄清石灰水吸收。