题目内容
【题目】某实验小组用石墨做电极进行电解水实验,为增加导电性,改用氢氧化钙饱和溶液进行电解,实验时除两个电极均有气泡冒出外,在正极石墨电极的附近溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
[资料]
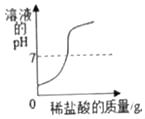
Ⅰ.氢氧化钙的溶解度曲线如图所示。

Ⅱ.氢氧化钙饱和溶液通电后温度约上升5℃。
[猜想]
①电解过程中溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②电解过程中水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极(主要成分是碳)有关。
[实验]
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取10mL Ca(OH)2饱和溶液,稍加热,溶液温度上升5℃ | 溶液中未出现白色浑浊 | |
2 |
| 用石墨做电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;a试管中溶液未出现白色浑浊;b试管中溶液明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;与电源正极相连的铜电极变墨,a、b试管中溶液未出现白色浑浊 |
(1)Ca(OH)2的溶液度随温度升高而__________(填“减少”或“增大”);实验1中当液温度上升5℃后得到的溶液为Ca(OH)2 __________(填“饱和”或“不饱和”)溶液。
(2)实验1得出的结论是___________________________________________________________。
(3)实验2,取b试管中白色浑浊溶液,加10mL水,振荡,发现试管中白色浑浊不溶解,据此证明猜想_______(填序号)不合理。
(4)实验3中更换石墨电极为铜电极的目的是__________________________________________;与电源正极相连的铜电极变黑的原因是_____________________________________________(用化学方程式表示);为除去铜电极上的黑色物质,需要的试剂是_____________(写一种即可)。
(5)通过探究过程,用石墨做电极进行实验时,正极石墨电极附近Ca(OH)2溶液出现白色浑浊的原因是__________________________________________________________________________。
【答案】减少 饱和 白色浑浊不是由于溶液温度升高时Ca(OH)2析出导致的 ② 验证出现白色浑浊与石墨电极有关 2Cu+O2=2CuO 稀硫酸 通电时,产生的氧气与石墨反应生成CO2,CO2和Ca(OH)2反应生成难溶于水的白色沉淀碳酸钙
【解析】
(1)由氢氧化钙的溶解度曲线可知,Ca(OH)2的溶解度随温度升高而减少;则实验1中当饱和Ca(OH)2溶液温度上升5℃后得到的溶液仍为饱和溶液;
(2)实验1中当饱和Ca(OH)2溶液温度上升5℃,溶液中未出现白色浑浊,说明白色浑浊不是由于溶液温度升高时Ca(OH)2析出导致的;
(3)实验2,取b试管中白色浑浊溶液,加10mL水,振荡,发现试管中白色浑浊不溶解,说明析出的白色浑浊不是Ca(OH)2,可判断猜想②不合理;
(4)实验3中更换石墨电极为铜电极的目的是验证出现白色浑浊与石墨电极有关;与电源正极相连的铜电极变黑,是因为2Cu+O2=2CuO,为除去氧化铜,需要的试剂是稀硫酸;
(5)用石墨做电极进行实验时,正极石墨电极附近Ca(OH)2溶液出现白色浑浊的原因是:通电时,产生的氧气与石墨反应生成CO2,CO2和Ca(OH)2反应生成难溶于水的白色沉淀碳酸钙。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案