题目内容
【题目】根据如图回答问题:

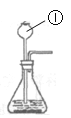
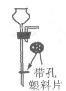
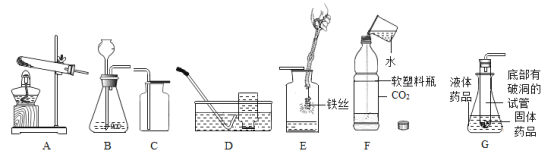
(1)仪器①的名称是______。
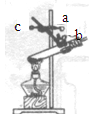
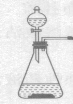
(2)实验室欲使用高锰酸钾制取氧气,发生的反应方程式是______。应选用的发生和收集装置是______(填字母)。
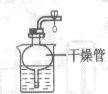
(3)实验室用石灰石和稀盐酸反应制取二氧化碳时,可选用发生装置A或G,G与A相比较,其优点是______;若用F装置收集二氧化碳,检验二氧化碳已收集满的方法是______。若选用A装置,检查装置气密性的方法是______。
【答案】长颈漏斗 2KMnO4![]() K2MnO4+MnO2+O2↑ BC或BE 可以控制反应的发生于停止 将燃着的木条放在b导管口,木条熄灭,证明集满 关闭弹簧夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于集气瓶中的液面,且两者液面差不再改变,就证明该装置气密性良好
K2MnO4+MnO2+O2↑ BC或BE 可以控制反应的发生于停止 将燃着的木条放在b导管口,木条熄灭,证明集满 关闭弹簧夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于集气瓶中的液面,且两者液面差不再改变,就证明该装置气密性良好
【解析】
(1)通过分析题中所指仪器的名称和作用可知,①是长颈漏斗;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑,该反应的反应物是固体,反应条件是加热,氧气密度比空气大,不易溶于水,所以应选用的发生和收集装置是BC或BE;
K2MnO4+MnO2+O2↑,该反应的反应物是固体,反应条件是加热,氧气密度比空气大,不易溶于水,所以应选用的发生和收集装置是BC或BE;
(3)G装置通过装置内压强的改变可以实现固体和液体的分离,优点是:可以控制反应的发生于停止,二氧化碳不具有助燃性,检验二氧化碳已收集满的方法是:将燃着的木条放在b导管口,木条熄灭,证明集满,利用装置内外的压强差检验装置气密性,所以选用A装置,检查装置气密性的方法是:关闭弹簧夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于集气瓶中的液面,且两者液面差不再改变,就证明该装置气密性良好。
故答案为:(1)长颈漏斗;(2)2KMnO4![]() K2MnO4+MnO2+O2↑,BC或BE;(3)可以控制反应的发生于停止,将燃着的木条放在b导管口,木条熄灭,证明集满,关闭弹簧夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于集气瓶中的液面,且两者液面差不不再改变,就证明该装置气密性良好。
K2MnO4+MnO2+O2↑,BC或BE;(3)可以控制反应的发生于停止,将燃着的木条放在b导管口,木条熄灭,证明集满,关闭弹簧夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于集气瓶中的液面,且两者液面差不不再改变,就证明该装置气密性良好。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】某实验小组用石墨做电极进行电解水实验,为增加导电性,改用氢氧化钙饱和溶液进行电解,实验时除两个电极均有气泡冒出外,在正极石墨电极的附近溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
[资料]
Ⅰ.氢氧化钙的溶解度曲线如图所示。

Ⅱ.氢氧化钙饱和溶液通电后温度约上升5℃。
[猜想]
①电解过程中溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②电解过程中水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极(主要成分是碳)有关。
[实验]
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取10mL Ca(OH)2饱和溶液,稍加热,溶液温度上升5℃ | 溶液中未出现白色浑浊 | |
2 |
| 用石墨做电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;a试管中溶液未出现白色浑浊;b试管中溶液明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;与电源正极相连的铜电极变墨,a、b试管中溶液未出现白色浑浊 |
(1)Ca(OH)2的溶液度随温度升高而__________(填“减少”或“增大”);实验1中当液温度上升5℃后得到的溶液为Ca(OH)2 __________(填“饱和”或“不饱和”)溶液。
(2)实验1得出的结论是___________________________________________________________。
(3)实验2,取b试管中白色浑浊溶液,加10mL水,振荡,发现试管中白色浑浊不溶解,据此证明猜想_______(填序号)不合理。
(4)实验3中更换石墨电极为铜电极的目的是__________________________________________;与电源正极相连的铜电极变黑的原因是_____________________________________________(用化学方程式表示);为除去铜电极上的黑色物质,需要的试剂是_____________(写一种即可)。
(5)通过探究过程,用石墨做电极进行实验时,正极石墨电极附近Ca(OH)2溶液出现白色浑浊的原因是__________________________________________________________________________。